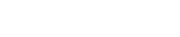医械资讯周刊 | 2024年9月第二期
医械资讯周刊 | 2024年9月第二期,本期要闻:1、2024年8月进口第一类医疗器械产品备案信息、2、心脏脉冲电场消融仪和一次性使用心脏脉冲电场消融导管获批上市、省局关于2024年8月批准注册第二类医疗器械产品的清单、创新医疗器械特别审查申请审查结果公示...
1、2024年8月进口第一类医疗器械产品备案信息
国家药品监督管理局发布了2024年8月进口一类医疗器械产品备案情况,具体涉及113种进口医疗器械的注册证状态改变。
2、心脏脉冲电场消融仪和一次性使用心脏脉冲电场消融导管获批上市
近日,国家药品监督管理局批准了美敦力公司“心脏脉冲电场消融仪”和“一次性使用心脏脉冲电场消融导管”两个创新产品注册申请。
心脏脉冲电场消融仪由发生器、控制器(可选)、脚踏开关(可选)、EGM线缆、一次性使用导管接口线缆组成。一次性使用心脏脉冲电场消融导管由电极、管身和手柄组成。
上述两个产品配套使用,利用脉冲电场的非热效应原理,治疗药物难治性、复发性、症状性阵发性房颤或药物难治性、复发性、症状性持续性房颤(发作持续时间小于1年)。与传统的射频消融及冷冻消融产品相比,该产品可实现对心肌组织的选择性破坏,避免温度传递导致的周围组织损伤风险。
3、省局关于2024年8月批准注册第二类医疗器械产品的清单
2024年8月,广东省药品监督管理局共批准注册第二类医疗器械产品280个,其中首次注册138个,延续注册142个(具体产品见原文链接附件)。
4、国家药监局关于废止YY 0605.9-2015《外科植入物 金属材料 第9部分:锻造高氮不锈钢》医疗器械行业标准的公告(2024年第113号)
24年8月,广东为进一步优化医疗器械标准体系,国家药品监督管理局决定废止YY 0605.9-2015《外科植入物 金属材料 第9部分:锻造高氮不锈钢》医疗器械行业标准,现予以公布(详细请见附件)。
5、创新医疗器械特别审查申请审查结果公示(2024年第8号)
依据国家药品监督管理局《创新医疗器械特别审查程序》(国家药监局2018年第83号公告)要求,创新医疗器械审查办公室组织有关专家对创新医疗器械特别审查申请进行了审查,拟同意以下申请项目进入特别审查程序,现予以公示。

公示时间:2024年9月13日至2024年9月29日
公示期内,任何单位和个人有异议的,可以书面、电话、邮件等方式向我中心综合业务部反映(电子邮箱:gcdivision@cmde.org.cn)。
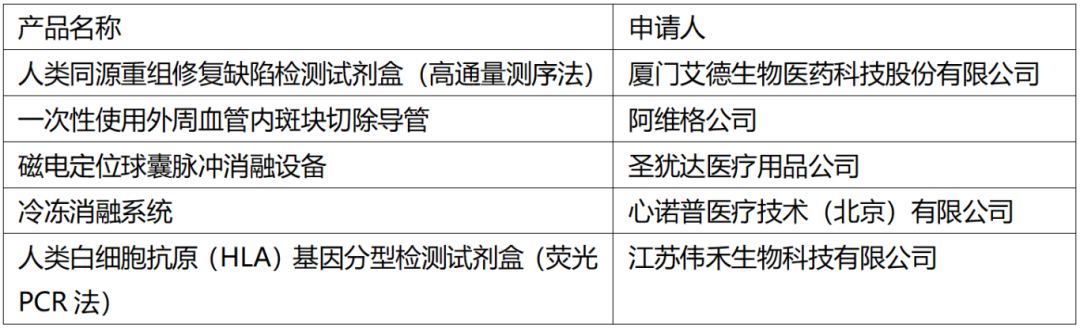
6、广东省药品监督管理局关于4家医疗器械生产企业恢复生产的通告
经广东省药品监督管理局组织复查,以下4家医疗器械生产企业已完成缺陷项目整改,符合《医疗器械生产质量管理规范》相关规定恢复生产。

7、广东省药品监督管理局关于注销《医疗器械生产许可证》的通告(2024年第7期)
按照《医疗器械监督管理条例》《医疗器械生产监督管理办法》有关规定,根据企业申请,广东省药品监督管理局依法注销深圳市金慧医疗科技有限公司等21家企业的《医疗器械生产许可证》。
8、国家药监局关于注销血细胞分析仪等2个医疗器械注册证书的公告(2024年第110号))
按照《医疗器械监督管理条例》的规定,根据企业申请,国家药品监督管理局现注销美国雅培公司2个产品的医疗器械注册证:血细胞分析仪,注册证编号:国械注进20162224758;全自动血细胞分析仪,注册证编号:国械注进20182220107。
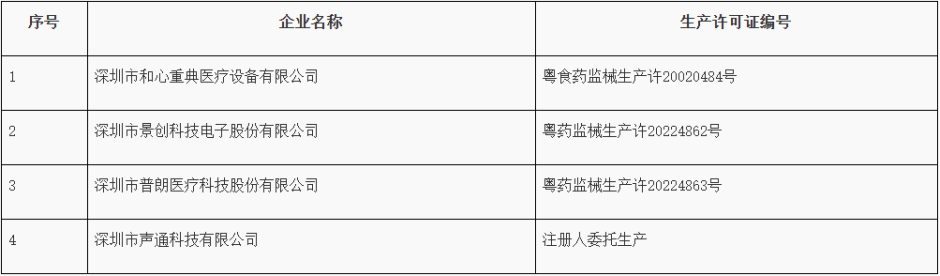
9、国家药监局关于发布国家医疗器械监督抽检结果的通告(2024年第35号)
被抽检项目不符合标准规定的医疗器械产品

对抽检发现的不符合标准规定产品,国家药品监督管理局已要求企业所在地省级药品监督管理部门按照《医疗器械监督管理条例》《医疗器械生产监督管理办法》《医疗器械召回管理办法》等要求,及时作出行政处理决定并向社会公布。省级药品监督管理部门要督促企业对抽检不符合标准规定产品进行风险评估,根据医疗器械缺陷的严重程度确定召回级别,主动召回产品并公开召回信息;督促企业尽快查明产品不合格原因,制定整改措施并按期整改到位。
10、如何确定同一注册单元内医用缝合针产品检验典型性
典型性产品是指能够涵盖本注册单元内全部产品工艺的一个或多个产品,如典型性产品应涵盖不同牌号不锈钢的产品,同一注册单元中有不同针型、不同牌号不锈钢的缝合针,则应分别进行检验。
11、牙科膜片产品注册单元应如何划分
通常由高分子材料组成,如对苯二甲酸乙二醇酯等,用于制作口腔矫治器、保持器、(牙合)垫等。主要组成成分不同的产品应划分为不同注册单元;成型工艺不同的产品应划分为不同的注册单元。仅色号不同的产品可以作为一个注册单元申报。
12、美国发布人因工程原则在组合产品中应用的指南
美国食品药品监督管理局(FDA)于2023年9月7日发布《人因工程原则在组合产品中的应用:提问与回答》指南。该指南以15个问答来阐明人因工程(Human Factor Engineering, HFE)在组合产品中应用需要考虑的因素。组合产品是指由药品、医疗器械或生物制品两种及以上类型产品结合而成的产品,范围广于我国所定义的药械组合产品。
人因工程确认研究一般会因为环境条件和用户反应难以模拟,而采用实际使用来进行确认研究。而临床研究的目的是证明产品的安全有效性,其目的与人因工程确认研究不同,因此不能作为人因工程确认研究。指南对形成性评估进行了简要介绍,形成性评估是人因工程评估过程的一部分,在确定用户需求以及用户界面如何影响用户交互方面发挥着重要作用。指南文件强调人因工程评估是迭代过程,但人因工程确认报告应在组合产品的最终成品上进行确认。指南对组合产品设计变更如何考量人因工程原则进行了简要说明。该文选取了以下五个方面介绍了人因工程原则在组合产品中应用需要考量的内容。详细内容请见原文链接。
服务赋能 协同创新 | 医疗器械产业质量提升交流会圆满举行
由华测纽唯发起的【广州开发区广州市黄埔区医疗器械行业质量基础设施服务工作站】于2024年5月10日15:00召开了黄埔区医疗器械行业质量提升交流会。
2024-05-20 00:51:42
医疗器械领域再获新突破!| 华测检测CMA扩项获证成功!
2024年2月27日,CTI华测检测有源医疗器械实验室(以下简称“华测医疗器械实验室”)顺利通过国家级CMA资质扩项评审,并已获得资质认定证书及扩项附表。
2024-03-04 00:43:27
CTI华测检测成功入围《深圳市医疗器械优质供应商推荐目录》
深圳市市场监督管理局为贯彻落实深圳市市委、市政府关于产业质量提升的工作部署,着力提升深圳市高端医疗器械产业质量竞争力,推动产业高质量发展,2023年4月11日,深圳市启动了医疗器械产业质量提升“灵渠”计划。
2024-01-22 06:37:44
- 热线电话
- 业务咨询
- 快速询价
- 在线客服
- 报告验证