医械产品注册方案| 一次性无菌注射器
注射器和注射针搭配使用,适用于人体皮内、皮下、肌肉、静脉等注射或抽取液体。一次性无菌注射器能够有效地减少注射过程中疾病交叉传染的发生。
一、注射器的一般组成和种类
在《GB 15810-2019一次性使用无菌注射器》标准中,推荐将注射针和注射器一起作为销售单元进行测试,以防分开测试对生产企业和测试单位带来极大不便和困难。因此一套一次性无菌注射器包括注射针与注射器两部分,而注射器还可以分为芯杆,活塞,外套三个部分。部分注射器的芯杆和活塞是相连一体的,被称为两件式注射器。
二、风险管理分类
在我国的医疗器械注册管理中:一次性无菌注射器风险等级管理类别为Ⅲ类;

三、注册单元划分和实例
着重考虑产品的工作原理、结构组成、主要组件的原材料、性能指标及适用范围等因素,如:防针刺结构的工作原理不同需划分为不同注册单元;主要组件“管路”的原材料不同或增塑剂不同需划分为不同注册单元;产品结构不同需划分为不同注册单元。
四、产品常见标准
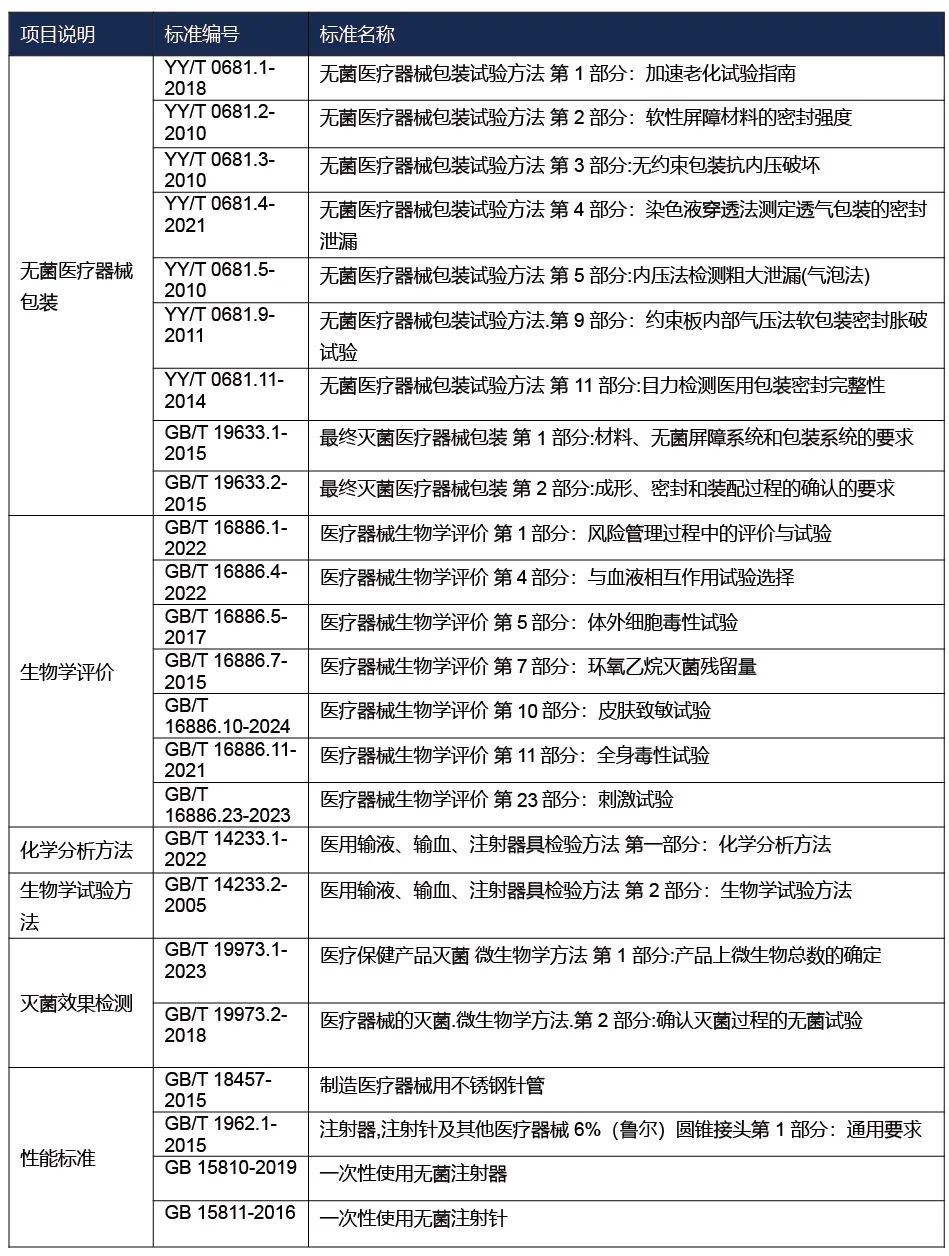
国内注册-检测方案
国外注册-检测方案
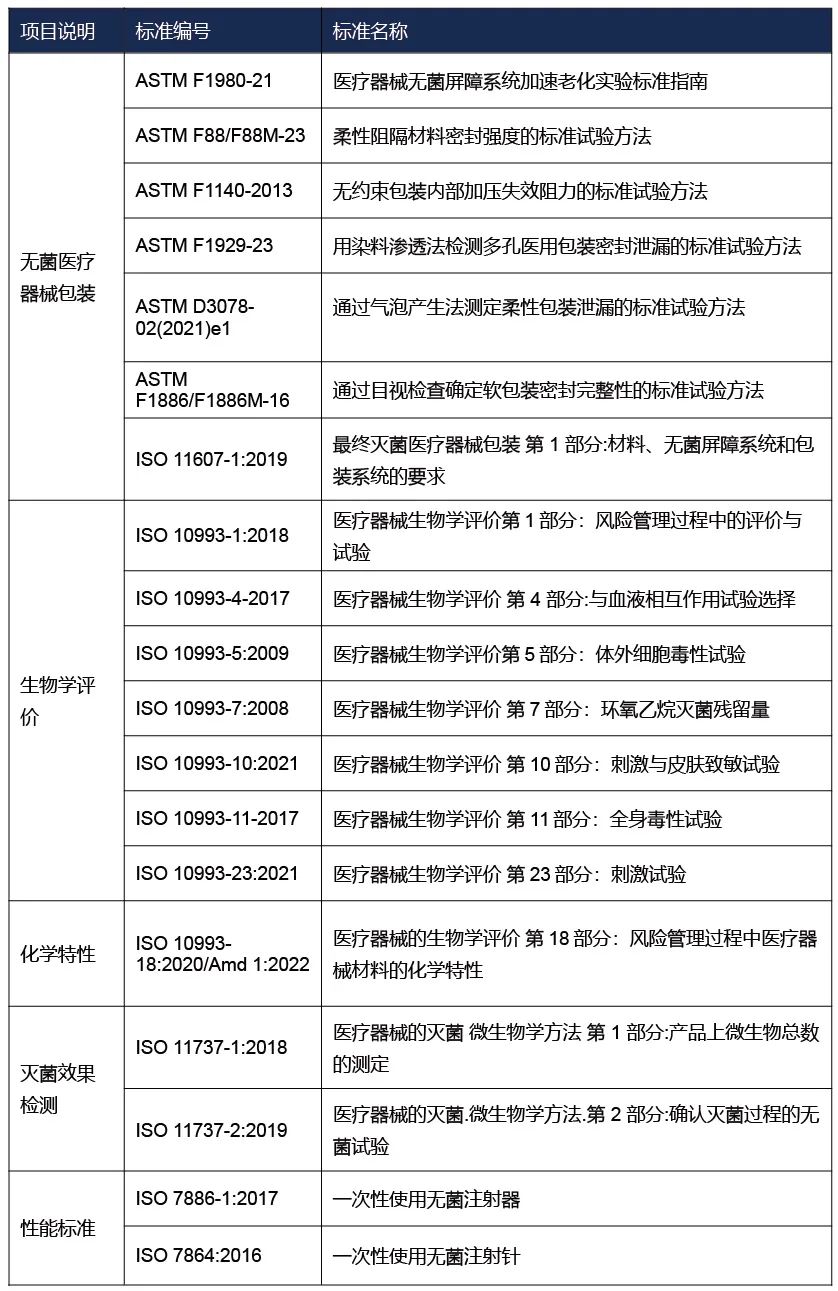
备注:上述标准包括了产品技术要求中经常涉及到的标准;企业需要根据产品的特点引用其他适用的标准。
华测检测医疗器械实验室目前已经获得了以上大部分生物学评价及包装运输标准的CNAS、CMA授权,测试项目包括生物相容性测试、材料化学表征、理化及微生物测试、包装运输及老化实验等,可以为医疗器械生产企业提供【一次性无菌注射器】全球市场准入的一站式注册检测服务方案。
@安徽企业,首次取得实验室CNAS、CMA资质,给予一次性奖补!
近日,中共蚌埠市委、蚌埠市人民政府联合印发《蚌埠市产业扶持政策清单》(以下简称《清单》)。《清单》明确提出支持检验检测业发展,对首次获得CNAS、CMA资质认定的企业法人检验检测机构,分别给予一次性 20万元、10万元奖补。
2022-07-12 02:43:40
2022年第一次国家农产品质量安全抽检总体合格率为97.7%
近日,农业农村部新闻办公室发布“2022年第一次国家农产品质量安全例行监测情况”。今年1-3月,农业农村部组织开展了2022年第一次国家农产品质量安全例行监测工作,抽检蔬菜、畜禽产品和水产品等3大类产品86个品种127项参数6910个样品,总体合格率为97.7%。
2022-05-11 05:31:30
CTI华测携手多宁生物共建一次性使用系统(SUS)检测验证平台
2021年4月30日,中国第三方检测认证行业的开拓者和领先者华测检测认证集团股份有限公司(简称CTI华测)与国内生物医药行业无血清培养基、一次性产品及生物反应器领域的主要供应商上海多宁生物科技有限公司 (简称多宁生物) 在沪签订实验室共建合作协议,致力于打造ISO17025 & cGMP双质量体系运行、高质量合规性的检测验证平台,为客户提供从一次性系统选型、产品质量监控、验证等一站式解决方案。
2021-04-29 06:25:20
- 热线电话
- 业务咨询
- 快速询价
- 在线客服
- 报告验证





