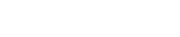医械资讯周刊 | 2024年10月第一期
医械资讯周刊 | 2024年10月第一期,本期要闻:国家药监局器审中心关于发布影像型超声诊断设备(第三类)注册审查指导原则(2023年修订版)的通告,国家药监局器审中心关于发布乳房植入体产品注册审查指导原则(2024年修订版)的通告,国家药监局关于批准注册444个医疗器械产品的公告,本周进口医疗器械召回信息汇总...
1、国家药监局器审中心关于发布影像型超声诊断设备(第三类)注册审查指导原则(2023年修订版)的通告(2024年第29号)
为进一步规范影像型超声诊断设备医疗器械的管理,国家药监局器审中心组织制订了《影像型超声诊断设备(第三类)注册审查指导原则(2023年修订版)》,现予发布。详细内容请见原文链接。
2、国家药监局器审中心关于发布乳房植入体产品注册审查指导原则(2024年修订版)的通告(2024年第28号)
为进一步规范乳房植入体医疗器械的管理,国家药监局器审中心组织修订了《乳房植入体产品注册审查指导原则(2024年修订版)》,现予发布。
3、国家药监局关于批准注册444个医疗器械产品的公告(2024年9月)(2024年 第128号)
2024年9月,国家药监局共批准注册医疗器械产品444个。其中,境内第三类医疗器械产品356个,进口第三类医疗器械产品56个,进口第二类医疗器械产品31个,港澳台医疗器械产品1个(具体产品见附件)。为保障公众用械安全,根据《医疗器械监督管理条例》和《医疗器械生产监督管理办法》有关规定,国家药监局决定自即日起,对韩国硕祺医疗株式会社膨体聚四氟乙烯面部植入物,暂停进口、经营和使用。
4、本周进口医疗器械召回信息汇总

.jpg)
5、创新医疗器械特别审查申请审查结果公示(2024年第9号)
依据国家药品监督管理局《创新医疗器械特别审查程序》(国家药监局2018年第83号公告),创新医疗器械审查办公室组织有关专家对创新医疗器械特别审查申请进行审查,拟同意以下申请项目进入特别审查程序,现予以公示。公示时间为2024年10月18日至11月1日。
公示期内,任何单位和个人如有异议,可书面提交异议意见,发送至中心电子邮箱:gcdivision@cmde.org.cn。
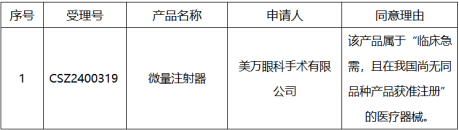
6、医疗器械优先审批申请审核结果公示(2024年第11号)
依据原国家食品药品监督管理总局《医疗器械优先审批程序》(总局公告2016年168号),对申请优先审批的医疗器械注册申请进行审核,现将符合优先审批情形的项目予以公示,公示时间为2024年10月18日至10月25日。

公示期内,任何单位和个人如有异议,可填写医疗器械优先审批项目异议表,提交至中心电子邮箱:gcdivision@cmde.org.cn。
服务赋能 协同创新 | 医疗器械产业质量提升交流会圆满举行
由华测纽唯发起的【广州开发区广州市黄埔区医疗器械行业质量基础设施服务工作站】于2024年5月10日15:00召开了黄埔区医疗器械行业质量提升交流会。
2024-05-20 00:51:42
医疗器械领域再获新突破!| 华测检测CMA扩项获证成功!
2024年2月27日,CTI华测检测有源医疗器械实验室(以下简称“华测医疗器械实验室”)顺利通过国家级CMA资质扩项评审,并已获得资质认定证书及扩项附表。
2024-03-04 00:43:27
CTI华测检测成功入围《深圳市医疗器械优质供应商推荐目录》
深圳市市场监督管理局为贯彻落实深圳市市委、市政府关于产业质量提升的工作部署,着力提升深圳市高端医疗器械产业质量竞争力,推动产业高质量发展,2023年4月11日,深圳市启动了医疗器械产业质量提升“灵渠”计划。
2024-01-22 06:37:44
- 热线电话
- 业务咨询
- 快速询价
- 在线客服
- 报告验证