医械资讯周刊 | 2024年8月第五期
1、国家药监局综合司公开征求《中华人民共和国医疗器械管理法(草案征求意见稿)》意见
为进一步加强医疗器械监督管理,保障医疗器械安全有效和促进产业高质量发展,更好满足人民群众对高质量医疗器械的需求,根据全国人大常委会立法规划,国家药监局研究起草了《中华人民共和国医疗器械管理法(草案征求意见稿)》,现向社会公开征求意见。欢迎社会各界积极提出意见建议,国家药监局将认真研究吸收,对于意见集中的问题,还将组织座谈交流和专题研究论证。有关意见建议可通过以下途径和方式反馈。
1.电子邮件反馈至zfsfgc@nmpa.gov.cn。发送邮件时,请在邮件主题处注明“《医疗器械管理法》公开征求意见反馈”。
2.信函邮寄至国家药品监督管理局政策法规司(北京市西城区展览路街道北露园1号,邮政编码100037),并请在信封上注明“《医疗器械管理法》公开征求意见反馈”字样。
2、上海市药品监督管理局关于发布《上海市医疗器械主动召回实施指南》的通告
为落实《医疗器械监督管理条例》《医疗器械召回管理办法》要求,指导医疗器械注册人备案人、经营企业、使用单位做好医疗器械主动召回工作,上海市药品监督管理局制定《上海市医疗器械主动召回实施指南》,现予发布。本指南供相关企业、单位依法参照实施。
3、血管斑块旋切控制装置和一次性使用外周血管斑块旋切导管获批上市
近日,国家药品监督管理局批准了波士顿科学公司“血管斑块旋切控制装置”和“一次性使用外周血管斑块旋切导管”两个创新产品注册申请。
血管斑块旋切控制装置由主机和电源线组成。一次性使用外周血管斑块旋切导管由电动导管、空间分离舱和可拆卸激活手柄组成。上述两个产品配套使用,用于股腘动脉原发性病变的经皮腔内斑块旋切预处理治疗。
与传统斑块切除器械相比,该产品采用旋切结合主动抽吸的创新设计,实现了斑块切除及主动抽吸-灌注功能,在提供更有效的斑块切除疗效的同时,将斑块颗粒通过抽吸系统排出体外,减少远端栓塞等不良事件的发生。
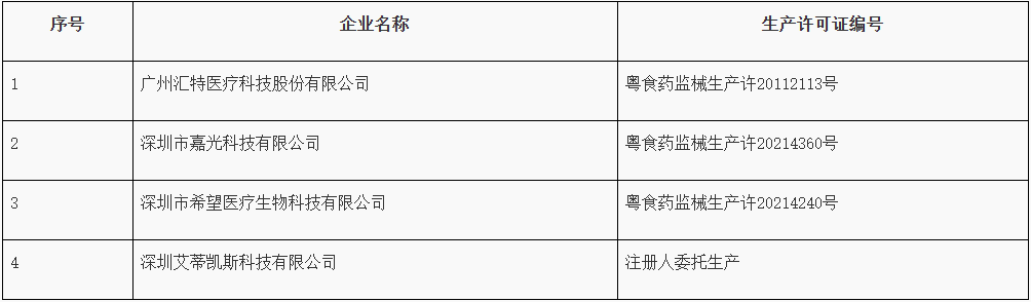
4、广东省药品监督管理局关于4家医疗器械生产企业暂停生产的通告
近期,广东省药品监督管理局组织开展医疗器械生产企业监督检查,发现以下4家企业质量管理体系存在严重缺陷,不符合《医疗器械生产质量管理规范》相关规定,广东省药品监督管理局已依法采取责令暂停生产的控制措施。

5、卓尔医疗(美国)公司ZOLL Medical Corporation对呼吸机主动召回
卓尔奥医疗科技(上海)有限公司报告,由于产品说明书更改了呼吸机在MRI环境下使用的安全距离对应的磁感应强度数值,生产商卓尔医疗(美国)公司ZOLL Medical Corporation对其生产的呼吸机(国械注进20163080928)主动召回。召回级别为一级召回。涉及产品的型号、规格及批次等详细信息见《医疗器械召回事件报告表》。
6、广州汉瑞祥和茂医疗器械有限公司对玻璃离子粘接水门汀主动召回
广州汉瑞祥和茂医疗器械有限公司生产的玻璃离子粘接水门汀,生产批号见附件,因在产品抽检中发现不符合产品技术要求文件2.5项的要求,广州汉瑞祥和茂医疗器械有限公司决定发起主动召回。
广州汉瑞祥和茂医疗器械有限公司对其生产的玻璃离子粘接水门汀(注册证号:国械注进20173171001号 生产批号:见附件)主动召回。召回级别为三级。涉及产品的型号、规格及批次等详细信息见《医疗器械召回事件报告表》。
7、国家药监局关于暂停进口、经营和使用韩国杰希思医疗公司Nd:YAG激光治疗仪的公告(2024年第107号)
国家药监局近期对韩国杰希思医疗公司(英文名称:Jeisys Medical Inc.)开展远程非现场检查,检查品种为Nd:YAG激光治疗仪(英文名称:Nd:YAG Laser surgery equipment;注册证号:国械注进20143015997)。检查发现韩国杰希思医疗公司在生产追溯、产品检验等方面存在质量管理体系严重缺陷,且未对抽检不合格项目采取有效纠正预防措施,Nd:YAG激光治疗仪存在质量安全隐患。
为保障公众用械安全,根据《医疗器械监督管理条例》和《医疗器械生产监督管理办法》有关规定,国家药监局决定自即日起,对韩国杰希思医疗公司Nd:YAG激光治疗仪,暂停进口、经营和使用。
服务赋能 协同创新 | 医疗器械产业质量提升交流会圆满举行
由华测纽唯发起的【广州开发区广州市黄埔区医疗器械行业质量基础设施服务工作站】于2024年5月10日15:00召开了黄埔区医疗器械行业质量提升交流会。
2024-05-20 00:51:42
医疗器械领域再获新突破!| 华测检测CMA扩项获证成功!
2024年2月27日,CTI华测检测有源医疗器械实验室(以下简称“华测医疗器械实验室”)顺利通过国家级CMA资质扩项评审,并已获得资质认定证书及扩项附表。
2024-03-04 00:43:27
CTI华测检测成功入围《深圳市医疗器械优质供应商推荐目录》
深圳市市场监督管理局为贯彻落实深圳市市委、市政府关于产业质量提升的工作部署,着力提升深圳市高端医疗器械产业质量竞争力,推动产业高质量发展,2023年4月11日,深圳市启动了医疗器械产业质量提升“灵渠”计划。
2024-01-22 06:37:44
- 热线电话
- 业务咨询
- 快速询价
- 在线客服
- 报告验证