医疗器械产品注册方案 | 重组胶原蛋白类产品
一、基本概念
胶原蛋白(简称胶原)是人体组织器官的主要结构蛋白,参与人体组织修复。目前已知的有28种类型胶原蛋白,约占人体蛋白质总量的30-40%,是人体最重要的组成材料。胶原蛋白材料在临床上广泛应用于人体皮肤、口腔、硬脑膜等组织的修复以及医疗美容等领域。目前国内外医疗器械市场的胶原产品主要由动物组织及同种异体组织(皮肤、胎盘等)制备。

重组胶原蛋白以生物体内胶原蛋白的氨基酸序列为模板,对其进行合理的设计、酶切和拼接后借助合成生物学技术转入到以大肠杆菌、毕赤酵母菌为主的工程细胞内,并利用工程细胞的快速生产能力制备获得的胶原蛋白。
二、重组胶原蛋白-政策支持
2021年3月《重组胶原蛋白生物材料命名指导原则》颁布
2021年4月《重组胶原蛋白类医疗产品分类界定原则》颁布
2022年8月《重组胶原蛋白》行业标准(YY/T1849—2022)正式实施
2023年1月《重组胶原蛋白生物材料命名指导原则》解读颁布
2023年5月《重组胶原蛋白创面敷料注册审查指导原则》《重组人源化胶原蛋白原材料评价指导原则》颁布
2023年7月YY/T 1888-2023《重组人源化胶原蛋白》医疗器械行业标准颁布
三、风险管理类别
根据国家药监局于2021年4月13日发布的《重组胶原蛋白类医疗产品分类界定原则》,重组胶原蛋白类产品的管理类别应当不低于第二类。可按如下进行分类界定:
第二类医疗器械:1)作为止血和防黏连材料应用时,若产品不可被人体吸收且仅用于体表时;2)作为医用敷料应用时,若产品不可被人体吸收且用于非慢性创面。
第三类医疗器械:1)无源植入物;2)作为止血和防黏连材料应用时,若产品可部分或全部被人体吸收或者用于体内;3)作为医用敷料应用时,若产品可部分或者全部被人体吸收,或者用于慢性创面。
四、性能指标
一般要求:外观、可见异物、装量、无菌、体外降解、体内降解等
物理性能要求:渗透压摩尔浓度、推挤力、热稳定性等
化学性能要求:
鉴别及成分定量:总蛋白含量、胶原蛋白纯度、分子量(电泳法)、分子量(高分辨质谱法)、等电点、氨基酸序列确认、肽段覆盖率、质谱法C末端序列分析、质谱法N末端序列分析、肽图、消光系数、电泳图型、液相层析图谱;-结构表征:氨基酸异质性分析、胶原蛋白原子结构解析、圆二色(CD)光谱、红外光谱分析、拉曼光谱、微量差示扫描量热谱;
杂质控制相关:重金属总量、微量元素、细菌内毒素、外源性DNA残留、宿主细胞蛋白残留、残余抗生素含量、残余抗生素活性、碳水化合物结构、炽灼残渣、酸碱度、有害小分子及添加剂残留量、分子变异体。
五、产品检测方案
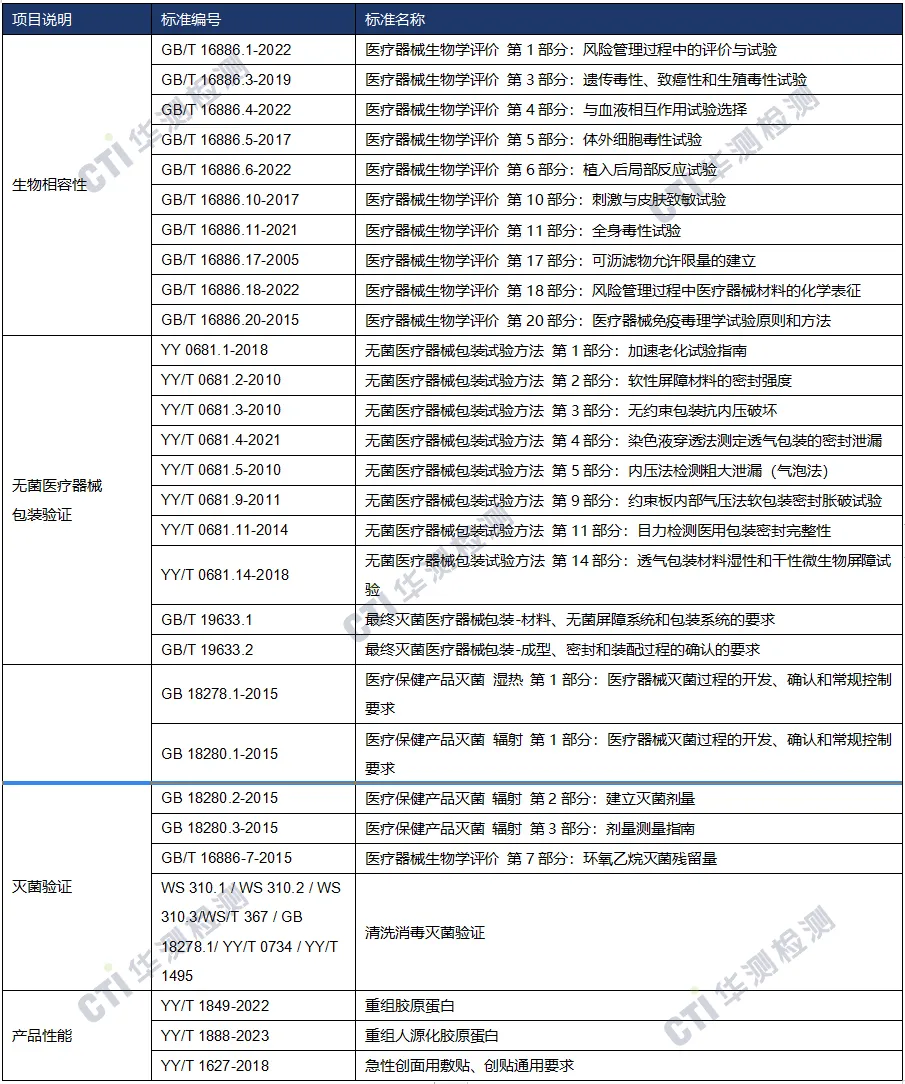
国内注册-检测方案
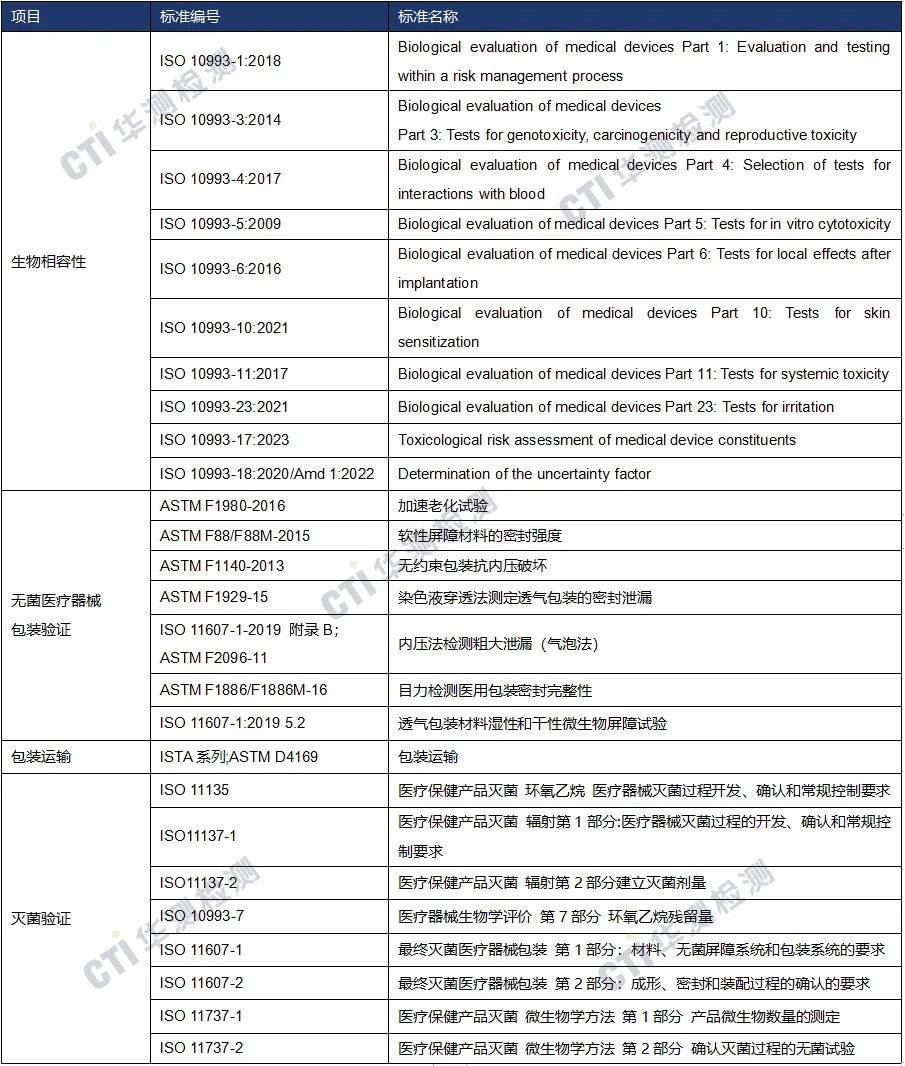
国际注册-检测方案
服务赋能 协同创新 | 医疗器械产业质量提升交流会圆满举行
由华测纽唯发起的【广州开发区广州市黄埔区医疗器械行业质量基础设施服务工作站】于2024年5月10日15:00召开了黄埔区医疗器械行业质量提升交流会。
2024-05-20 00:51:42
医疗器械领域再获新突破!| 华测检测CMA扩项获证成功!
2024年2月27日,CTI华测检测有源医疗器械实验室(以下简称“华测医疗器械实验室”)顺利通过国家级CMA资质扩项评审,并已获得资质认定证书及扩项附表。
2024-03-04 00:43:27
CTI华测检测成功入围《深圳市医疗器械优质供应商推荐目录》
深圳市市场监督管理局为贯彻落实深圳市市委、市政府关于产业质量提升的工作部署,着力提升深圳市高端医疗器械产业质量竞争力,推动产业高质量发展,2023年4月11日,深圳市启动了医疗器械产业质量提升“灵渠”计划。
2024-01-22 06:37:44
- 热线电话
- 业务咨询
- 快速询价
- 在线客服
- 报告验证





