医疗器械产品注册方案 | 可吸收缝合线
一、基本概念
产品描述:通常由各种非动物来源的单体材料聚合或多个单体共聚制成的可降解吸收的缝合线。缝合线表面可有涂层,分为带针和不带针两种。不包括预期用于骨结合的缝线。无菌提供,一次性使用。

预期用途:用于体内软组织、器官和/或皮肤的缝合和/或结扎。
二、风险管理类别
依据《医疗器械分类目录》,可吸收缝合线的管理类别为III类医疗器械,分类编码02-13-06。
三、性能指标
物理性能:至少包括产品外观、规格与直径、抗张强度、长度、针线连接强度(如适用)、缝针性能(如适用,参考YY0043制定)等;
化学性能:a)对于人工合成的可吸收缝线,应包括红外及核磁鉴别、平均分子量、分子量分布(如适用)、单体残留、催化剂残留、溶剂残留、含水量、重金属含量、褪色试验、环氧乙烷残留量(如适用)、终产品中其他有害小分子物质的残留量要求等。b)对于动物源性材料制成的可吸收缝线,至少应包括材料定性要求、材料纯度要求、重金属残留、可溶性铬化合物试验(铬制缝线适用)、免疫原性或相关性能的控制指标(以证明产品的免疫原性可控制在可接受范围)、终产品中有害物质的残留量要求等。
其他:如降解吸收性能、无菌、热原等
四、产品检测方案
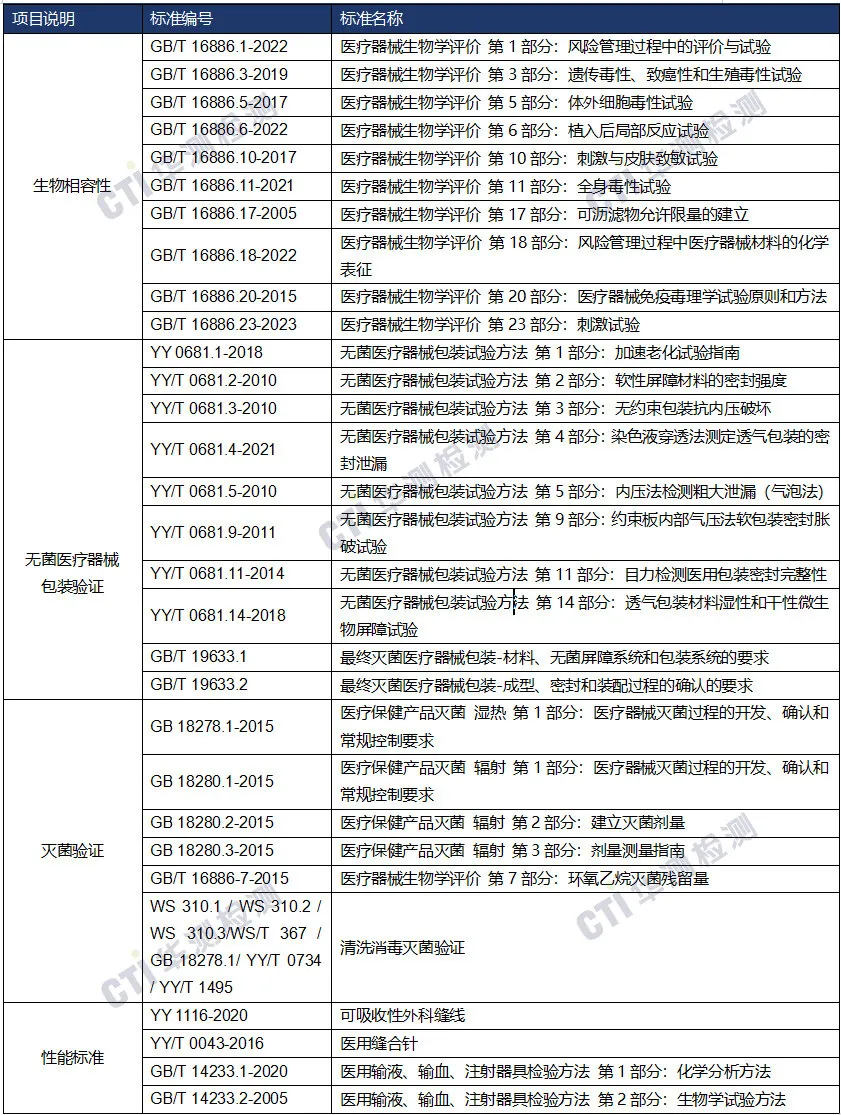
国内注册-检测方案
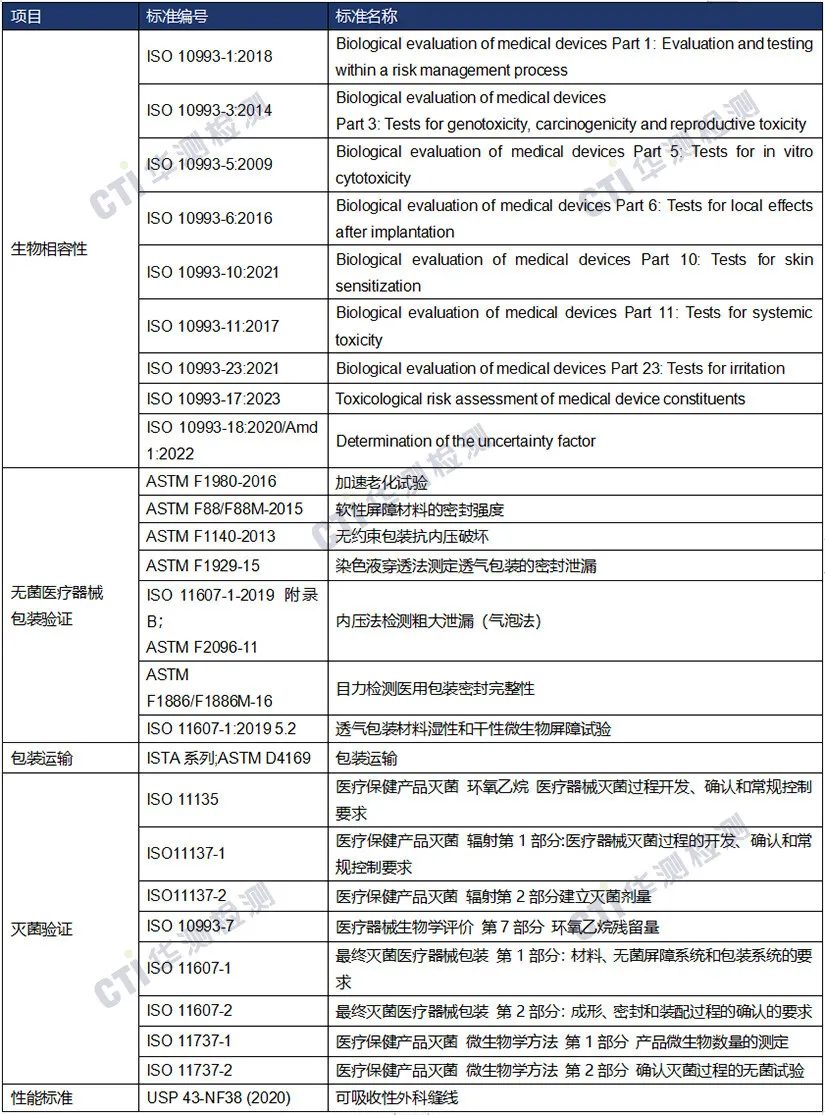
国际注册-检测方案
服务赋能 协同创新 | 医疗器械产业质量提升交流会圆满举行
由华测纽唯发起的【广州开发区广州市黄埔区医疗器械行业质量基础设施服务工作站】于2024年5月10日15:00召开了黄埔区医疗器械行业质量提升交流会。
2024-05-20 00:51:42
医疗器械领域再获新突破!| 华测检测CMA扩项获证成功!
2024年2月27日,CTI华测检测有源医疗器械实验室(以下简称“华测医疗器械实验室”)顺利通过国家级CMA资质扩项评审,并已获得资质认定证书及扩项附表。
2024-03-04 00:43:27
CTI华测检测成功入围《深圳市医疗器械优质供应商推荐目录》
深圳市市场监督管理局为贯彻落实深圳市市委、市政府关于产业质量提升的工作部署,着力提升深圳市高端医疗器械产业质量竞争力,推动产业高质量发展,2023年4月11日,深圳市启动了医疗器械产业质量提升“灵渠”计划。
2024-01-22 06:37:44
- 热线电话
- 业务咨询
- 快速询价
- 在线客服
- 报告验证