医药探秘 | 医疗器械化学表征:可提取物和可沥滤物分析
一、研究背景
医疗器械的生产材料和使用方法存在较大差异,材料类型包括合成及天然聚合物,金属,陶瓷,复合材料等,与身体的接触时间和接触频率也不尽相同,当医疗器械直接或间接和人体接触时,需要进行生物学评估确保其安全性。2005年 ISO技术委员会发布了化学表征标准的第一版ISO 10993-18[1],并在2020年进行修订。根据标准定义,化学表征为通过信息收集或者信息生成来获得化学信息的过程。通过化学表征来确定生产制造材料中是否存在临床使用过程中可能产生潜在化学危害的化学物质,同时最大限度的减少动物实验。因此化学表征是进行生物相容性评价的初步步骤,可用于识别可能接触的危险化学物质(如:引起全身毒,遗传毒,致癌毒,生殖毒性和发育毒性的物质)。
一份科学合理的化学表征合格报告可豁免部分生物相容性测试。特别是在GB/T16886.1-2022实施以后,越来越多医疗器械企业把化学表征研究当做医疗器械生物安全评价的第一步。
二、化学表征流程
1. 信息收集
化学表征始于信息搜集,涵盖医疗器械材质、工艺等详细信息,涉及器械类别、组成、临床用途、生产工艺、法规要求等。器械常采用聚合物、金属、陶瓷等材料制造,其中聚合物可能释出脂肪酸、聚酯、硅烷类及各类添加剂(如增塑剂、固化剂、稳定剂、抗氧化剂、着色剂等),以确保材料性能。工艺环节,如包装、灭菌等,亦会改变可提取物的种类与含量,如热处理可能导致单体、未聚合物或降解产物等副产品出现。故从原料至生产全程,识别潜在可提取物对于优化后续分析测试至关重要。
2. 可提取物和可沥滤物分析
由于材料和制造过程的多样性,信息收集不足以得到所有终产品的有害化学物质成分,因此,需要进行信息生成过程即可提取物和可沥滤物分析。
● 可浸提物(Extractable):使用实验室浸提条件和浸提介质对医疗器械或器械构造材料进行浸提时释放出的物质。
● 可沥滤物(Leachable):医疗器械可沥滤物(Leachables)是指医疗器械或材料在临床使用过程中释放出的物质的统称:一般包括灭菌残留剂、工艺残留物、降解产物以及材料中的单体及添加剂(包括稳定剂、抗氧化剂、 增塑剂、着色剂等)等。
2.1 提取方案设计
进行可提取物和可沥滤物分析第一步需要进行提取方案设计。提取条件通常根据器械临床使用的条件,在假设的最坏情况下进行提取,因此,提取通常是在夸大或极限的条件下进行。提取的条件包括温度,不同极性的溶剂,溶剂体积和样品的比例,时间等。应该根据器械的临床使用条件,或者37度或者更高的提取温度,但也应注意过高的温度会带来提取物的高估,同时选择提取溶剂时候,也要考虑到聚合物本身的性质,避免使用破坏器械完整性或者使其溶胀的溶剂,根据10993-12[2]和10993-18的建议,提取条件的选择见下:
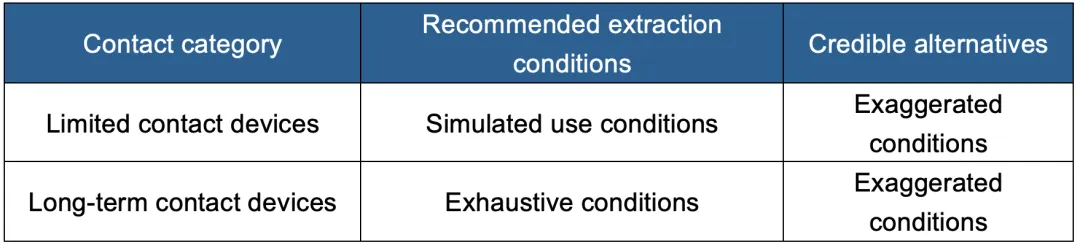
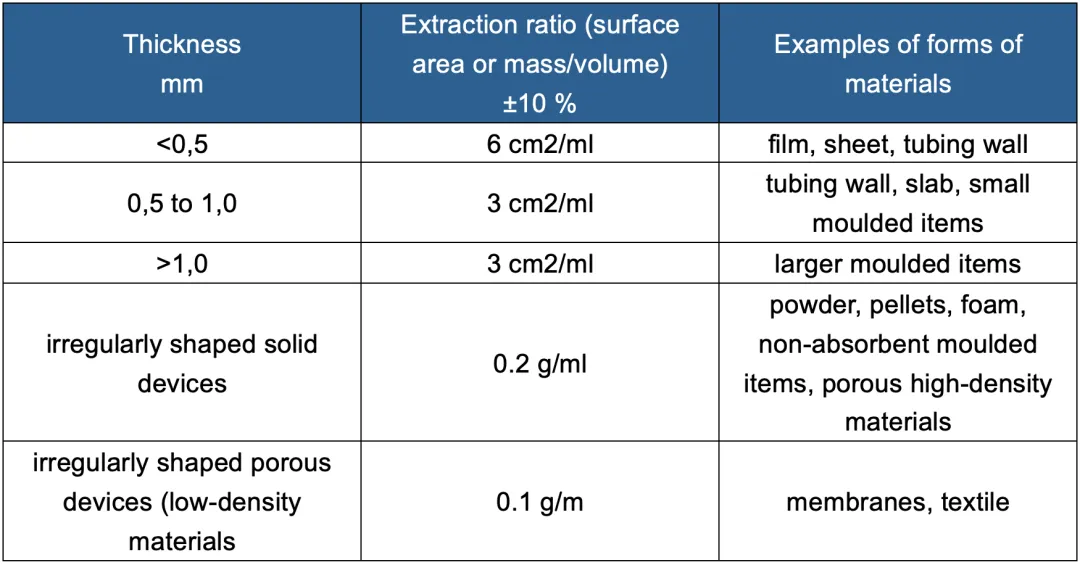
2.2 AET的确认
AET:分析评估阈值,即低于该阈值的可提取物与浸出物,不需要定性或者定量,也无需进行毒理学评估。AET起源于药物包装材料的分析,由PQRI提出。ISO 10993-18的标准中,使用基于剂量的阈值DBT来代替SCT,DBT是根据暴露时间,在TTC的基础上选择的,但是高毒性物质(如亚硝胺等)被排除在外,该类物质通常需要额外的目标物分析。

A - 提取的医疗器械数量
B - 提取液体积(mL)
C - 临床最大使用的医疗器械数量
DBT - 基于剂量的阈值(TTC),可参见ISO/TS 21726
UF - 分析不确定度因子(FDA推荐GCMS为4,LCMS为10)
DBT阈值的选择,ISO/TS 21726[3]的建议如下:

2.3 定性与定量分析
确定好AET之后,即可根据阈值建立对应的分析方法。可提取物的种类复杂,通常可分为vocs(小分子挥发物),svocs(半挥发性化合物),nvocs(不挥发性化合物)和无机元素杂质,需要对对应的物质种类建立不同的分析方法。

目前,广泛应用扫描法进行可提取物的非靶向半定量分析,MRM(多重反应监控)的方法虽然具有更高的检测灵敏度,但是由于其目标化合物的检测方式,目前不被监管机构所接受。在进行半定量分析的时候,虽然在AET的计算过程中已经引入了UF不确定度因子,但是合适的定量标准品的选择也至关重要[4],响应过高或者过低都会造成筛查阈值的变化。此外,半定量的时候也应该考虑到不同化合物的响应差距,应使用相对响应因子RRF来提高定量的准确度。
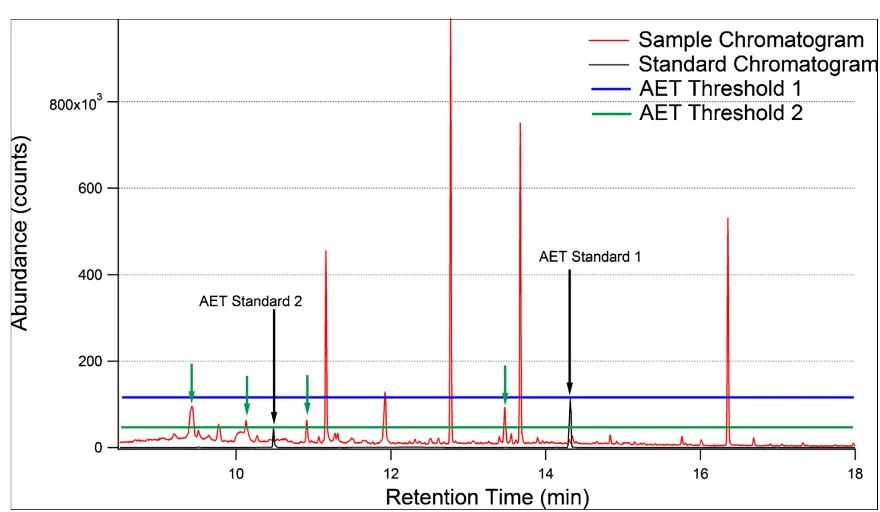
图片来源:Mark Anderson Jordi, et al.(2020)
在非目标物分析中,需要对所有超过AET的化合物进行定性分析,确定化合物的结构信息。根据Jenke[5]的分类,EL中化合物的鉴定程度,可以分为unidentified,partial,tentative,confident,confirmed几类。
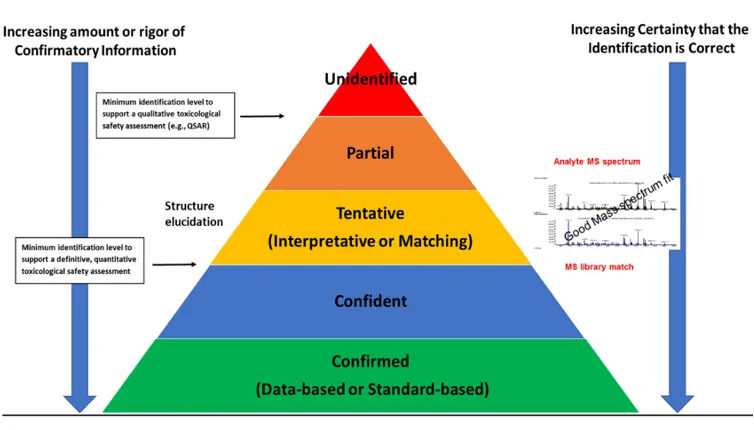
图片来源:Dennis Jenke. 2020
定性分析往往是一个复杂的工作。可提取物的种类宽泛,大部分物质不存在官方标准品,同时,依赖数据库匹配进行的鉴定往往结果并不可信,常常需要人工解谱以及样品的背景信息来获得更高的鉴定程度,而错误的鉴定可能会带来错误的毒理学评估结果。使用高分辨质谱,利用同位素,分子量等特征,对未知物进行尽可能的鉴定,同时,可建立内部的质谱数据库来提升鉴定准确度。
三、总结
本文叙述了医疗器械化学表征的一般流程,从信息收集,提取方案设计,AET的确认到可提取物的定性与定量分析,化学表征是一个需要团队参与的过程,而其中未知物的定性和定量,更是重点和难点。
华测医药实验室搭建的化学表征质谱平台,配备超高分辨率Orbitrap HF-X质谱仪的液相色谱-高分辨质谱系统(LC-HRMS)、高性能AB Sciex 5500液相色谱-串联质谱仪(LCMS/MS)、气相色谱-质谱联用仪(GC-MS)、以及热裂解-质谱(HS-MS)等多种先进质谱分析技术手段。依托强大的硬件设施,实验室团队积累了深厚的医疗器械化学成分分析项目执行经验。
此外,华测医药实验室已成功搭建基于高分辨质谱技术的医疗器械可提取物与可沥滤物专属数据库,囊括了数千种详尽的化合物信息,能够准确识别并量化医疗器械在实际应用过程中可能产生的各种化学物质,从而为客户提供全方位、高质量的医疗器械化学表征服务。通过定性定量分析,帮助客户满足严格的监管要求,保障医疗器械的安全性和有效性,有力推动医疗器械产业的技术创新与健康发展。
参考文献:
- ISO 10993-18:2020 Biological evaluation of medical devices Part 18: Chemical characterization of medical device materials withina risk management process; International Organization for Standardization (ISO): Geneva, Switzerland, 2020
- ISO 10993-12:Biological evaluation of medical devices — Part 12: Sample preparation and reference materials; International Organization for Standardization (ISO): Geneva, Switzerland, 2020
- ISO ISO/TS 21726:2019 Biological evaluation of medical devices Application of the threshold of toxicological concern (TTC) for Assessing biocompatibility of medical device constituents; International Organization for Standardization (ISO): Geneva, Switzerland, 2019
- Mark Anderson Jordi,et al. Reducing relative response factor variation using a multidetector approach for extractables and leachables (E&L) analysis to mitigate the need for uncertainty factors, J. Pharm. Biomed. Anal. 186 (2020).
- Dennis Jenke. Identification and Quantitation Classifications for Extractables and Leachables. PDA J Pharm Sci and Tech 2020, 74 275-285
- GB/T 16886.1-2022/IS0 10993-1:2018
服务赋能 协同创新 | 医疗器械产业质量提升交流会圆满举行
由华测纽唯发起的【广州开发区广州市黄埔区医疗器械行业质量基础设施服务工作站】于2024年5月10日15:00召开了黄埔区医疗器械行业质量提升交流会。
2024-05-20 00:51:42
医疗器械领域再获新突破!| 华测检测CMA扩项获证成功!
2024年2月27日,CTI华测检测有源医疗器械实验室(以下简称“华测医疗器械实验室”)顺利通过国家级CMA资质扩项评审,并已获得资质认定证书及扩项附表。
2024-03-04 00:43:27
CTI华测检测成功入围《深圳市医疗器械优质供应商推荐目录》
深圳市市场监督管理局为贯彻落实深圳市市委、市政府关于产业质量提升的工作部署,着力提升深圳市高端医疗器械产业质量竞争力,推动产业高质量发展,2023年4月11日,深圳市启动了医疗器械产业质量提升“灵渠”计划。
2024-01-22 06:37:44
- 热线电话
- 业务咨询
- 快速询价
- 在线客服
- 报告验证





