医药探秘 | 解码分析仪器PQ:风险管理下的性能优化策略
USP<1058 Analytical Instrument Qualification>中,以数据质量三角形模型的形式,来定位仪器确认在数据管理中的地位(如图1)。因此,在分析方法验证之前,有必要进行分析仪器确认,并通过以书面证据形式来证明仪器能够获得稳定、可靠和准确的分析数据。
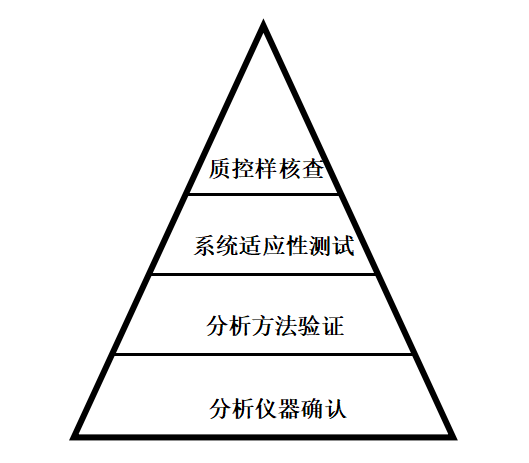
图1数据质量的组成
《药品生产质量管理规范(2010年修订)》第144条指出:首次确认或验证后,应当定期进行再验证,确保其能够达到预期结果;第140条(4)指出:性能确认(PQ,Performance Qualification)的预定目标是证明在正常操作方法和工艺条件下能够持续符合标准。
因此,分析仪器的性能应当贯彻分析仪器的整个生命周期,基于风险评估来确定性能再确认的周期。结合图1数据质量的组成,可以看出不能简单地将分析方法验证的部分测试或系统适应性来作为仪器性能再确认的内容。
那么如何确定分析仪器性能确认的测试项目?分析仪器性能确认的关注重点是什么呢?
本文以药企质量控制(QC)实验室常见的分析仪器——高效液相色谱仪(HPLC)为例,从风险管理以及影响高效液相色谱仪稳定性、准确性的仪器因素出发,对性能确认的测试项目和关注重点进行诠释。
分析仪器PQ测试项目的确定
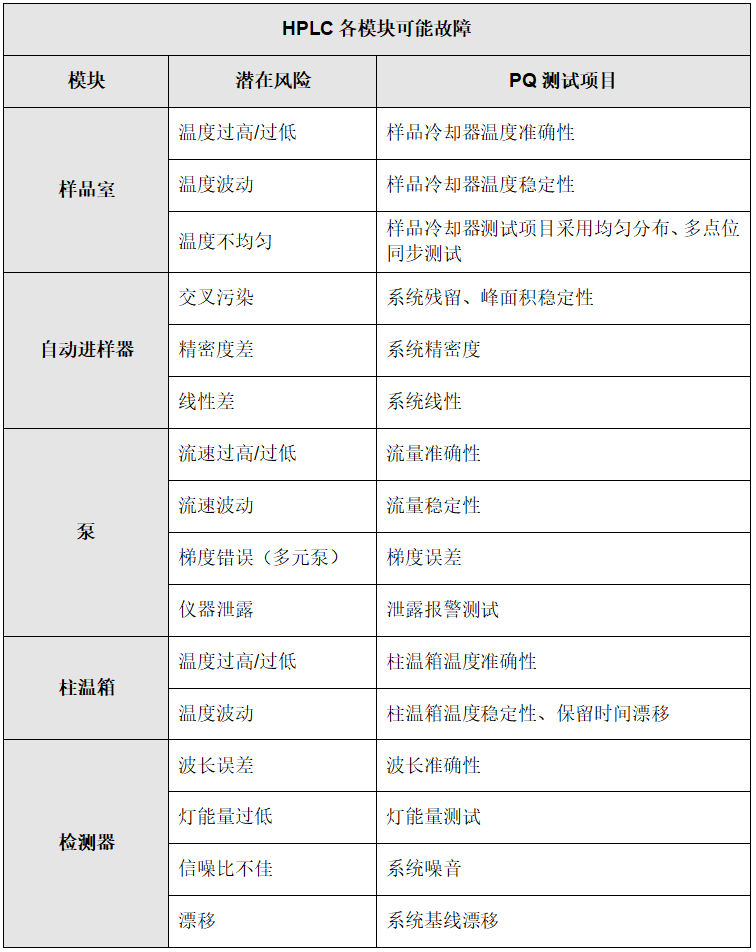
高效液相色谱仪主要由几个模块组成:样品室、自动进样器、泵(流路系统)、柱温箱和检测器。其中每个模块都可能存在潜在风险,从而影响分析方法验证数据的质量。《中国药典2020版》9101分析方法验证的主要指标要求:准确度、精密度、灵敏度、漂移、线性等。
按照风险管理的预防为主原则,应当在分析仪器首次验证或周期性性能确认时,确保能识别高效液相色谱仪的潜在风险。下表将从高效液相色谱仪的潜在风险和仪器生命周期的操作特点,来设计性能确认的测试项目,并做到逐一对应。
分析仪器PQ频率
分析仪器的性能确认(PQ)频率,关系到仪器性能状态,只有严格执行周期性性能确,才能保证分析仪器持续生成稳定、可靠和准确的分析数据。
在分析仪器的整个生命周期内,PQ频率不是一尘不变的,随着分析仪器服役时间的加长,应根据设备的稳定性、实际使用情况和测试的重要性来调整PQ频率。
在某些情况下,由于仪器的非计划性维护、维修或重要部件的升级或变更、仪器的搬迁等,还应根据评估进行不定期的性能确认。当出现下面所列情况时,通常需要重新进行PQ:
1.分析仪器从原来的地方移至新的地方,但其使用目的不变。
2.分析仪器既定使用功能发生变更或增添。
3.影响分析仪器既定使用功能的软硬件发生维修,根据维修内容来确定再确认的测试项目。
风险管理下的分析仪器PQ优化策略
分析仪器的生命周期管理是一个动态发展的,药企质量人员和设备管理员不应简单地照搬法规和指南的推荐性PQ测试项目和测试频率,而应该从本质上理解性能确认PQ的目的和意义。
在此基础上,才能实现用风险管理手段对分析仪器进行性能监控,使其满足药品质量检测的要求。
参考文献:
1.美国药典委员会.United States Pharmacopeia(USP)[S/OL].[2024-04-20].https://www.uspnf.com/
2.国家食品药品监督管理局.药品生产质量管理规范(2010年修订)[A/OL].(2011-01-17)[2022-05-15].https://www.samr.gov.cn/zw/zfxxgk/fdzdgknr/bgt/art/2023/art_d5e1dbaa8f284277a5f6c3e2fc840d00.html
3.国家药典委员会.中华人民共和国药典四部[M].北京:中国医药科技出版社,2020:480-483.
实力见证 | 华测药品检测服务能力再升级,CNAS/CMA 扩项评审圆满通过!
华测药品检测服务展现出卓越的专业实力。评审涵盖5大核心领域,共计41个具体项目,涉及医疗器械的化学与微生物检测、洁净室环境评估、以及实验室电气设备(如高低温试验箱)的性能验证。华测药品检测服务在所有参评项目中均获得了一致认可。
2024-06-18 06:55:33
专业卓越|华测医药参与国标制定,助力药品包装密封完整性新规范
2024年2月19日,华测医药药品检测服务在国家标准制定工作中表现出高度的行业参与度和影响力,以其深厚的专业底蕴和技术积累,积极参与了国家药典委员会主导的药品包装材料密封完整性的国标起草流程。
2024-03-21 07:32:06
CTI华测检测邀您参与《药品注册标准的撰写与注意事项》专题沙龙
药品标准是衡量药品安全、有效和质量可控的标尺,是药品研发和生产的重要目标之一,也是药品使用过程中用以判断药品是否能达到药用要求的重要衡量手段。为规范和加强药品标准管理,建立最严谨的药品标准,保障药品安全、有效和质量可控,促进药品高质量发展,我协会拟于2023年12月12日下午举办药品注册标准的撰写与注意事项专题沙龙,邀请医药行业专家和企业老师一同走进华测南方基地交流学习。
2023-12-11 09:22:13
- 热线电话
- 业务咨询
- 快速询价
- 在线客服
- 报告验证