MDCG指南下的无医疗预期用途产品分类界定及等同性验证介绍
2023年12月,欧盟委员会医疗器械协调小组(MDCG)连续发布了2份有关无医疗预期用途产品指南文件,分别是:MDCG 2023-5(分类鉴定)和MDCG 2023-6(等同性验证)。这两份指南一方面是针对非医疗用途两份CS指南“CS”(EU)2022/2346“CS”(EU)2022/2347的协调和补充,另一方面从等同性角度,也在MDCG 2020-5指南基础上做了比较详细的介绍。
MDCG 2023-5无预期医疗用途产品的鉴定及分类

MDCG 2023-5该指南先明确指出无预期医疗目的的器械应该先进行界定再分类,只有符合器械界定且被CS和MDR覆盖的产品才应根据MDR的附录VIII和法规(EU)2022/2347中的规则进行分类,该指南应与MDCG 2021-24参考使用。
同时指出,两用器械的分类应同时考虑医疗和非医疗目的。如果根据设备的预期用途,多个规则或同一规则中的多个子规则适用于同一设备,则应适用最严格的规则和导致更高分类的子规则。
01界定的实际问题

MDR附录XVI中所列出的器械组的描述包括法规本身未详细定义或详细解释的术语或概念。下表提供了关于如何考虑这些术语或概念的指导:
另外指南中还列举了不符合Annex XVI产品资格的产品示例的清单,此文不做详细列明。
02无预期医疗用途产品的分类规则
第1组有关隐形眼镜
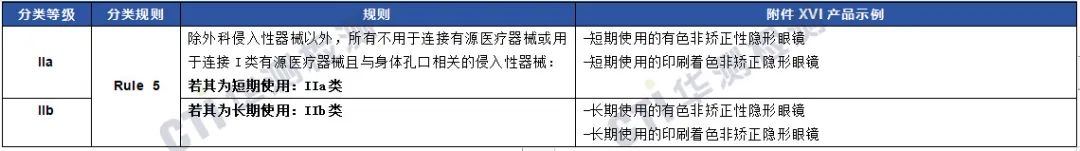
第2组通过侵入性手段植入体内以改变解剖结构的产品

第3组用于面部或其他真皮或粘膜填充的产品
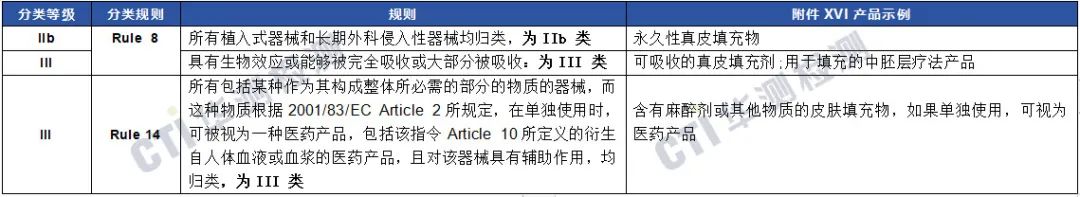
第4组旨在减少、去除或破坏脂肪组织的器械

第5组于人体的高强度电磁辐射设备
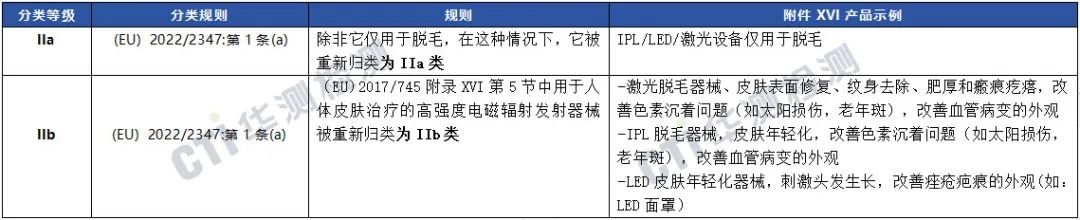
第6组用于脑刺激的器械

MDCG 2023-6无预期医疗用途的等同性验证器械等同性证明指南

在该指南中,无预期医疗用途器械等同性证明存在三种情况,具体如下:
1、两种非预期医疗用途的器械
在参考等效器械的临床数据时,制造商应考虑应根据MDR中制定的标准证明没有预期医疗目的的两种器械之间的等效性,重点考虑技术、生物学和临床特征等方面。
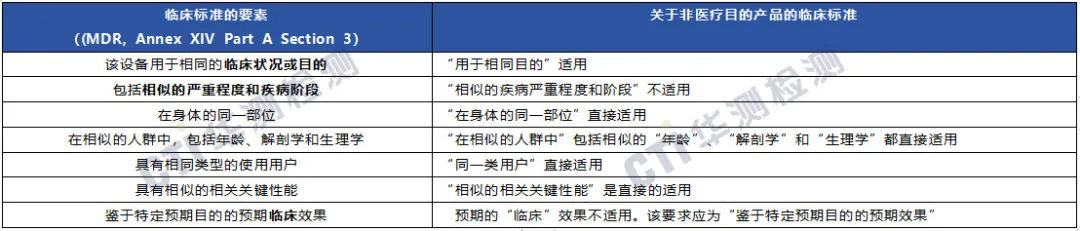
2、无预期医疗用途的产品与类似医疗器械产品
通常,医疗器械和无预期医疗用途的产品之间不可能进行直接的比较,因为并非所有临床特征都能进行比较。特别是"疾病的严重程度和阶段相似"这一特征对于医疗器械来说是可以的,而对于无预期医疗用途的产品来说是无法定义和获得的。因此,无预期医疗用途的器械与有医疗用途的类似器械之间无法完成和建立等同性证明。
3、无预期医疗用途器械vs双重用途医疗器械
没有预期医疗目的的产品与具有医疗和非医疗目的的器械(双重用途器械)之间的等效性可以通过比较两种器械与非医疗目的相关的特性来证明。对于双重用途器械,只应考虑与非医疗用途相关的特性。
如果证明了等效性,则只有与适用于非医疗目的的一般安全和性能要求相关的双重用途器械的临床数据才能用于无预期医疗目的的产品的临床评价。
服务赋能 协同创新 | 医疗器械产业质量提升交流会圆满举行
由华测纽唯发起的【广州开发区广州市黄埔区医疗器械行业质量基础设施服务工作站】于2024年5月10日15:00召开了黄埔区医疗器械行业质量提升交流会。
2024-05-20 00:51:42
医疗器械领域再获新突破!| 华测检测CMA扩项获证成功!
2024年2月27日,CTI华测检测有源医疗器械实验室(以下简称“华测医疗器械实验室”)顺利通过国家级CMA资质扩项评审,并已获得资质认定证书及扩项附表。
2024-03-04 00:43:27
CTI华测检测成功入围《深圳市医疗器械优质供应商推荐目录》
深圳市市场监督管理局为贯彻落实深圳市市委、市政府关于产业质量提升的工作部署,着力提升深圳市高端医疗器械产业质量竞争力,推动产业高质量发展,2023年4月11日,深圳市启动了医疗器械产业质量提升“灵渠”计划。
2024-01-22 06:37:44
- 热线电话
- 业务咨询
- 快速询价
- 在线客服
- 报告验证





