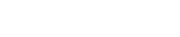医药探秘 | 药械洁净生产环境的守护者:消毒剂效力验证(二)
消毒剂对微生物杀灭效力受消毒剂种类、浓度、使用温度、接触作用时间、被消毒物体性质及其表面污染微生物的种类及生长状态等情况的影响,具体可通过消毒剂效力评估试验进行确认。
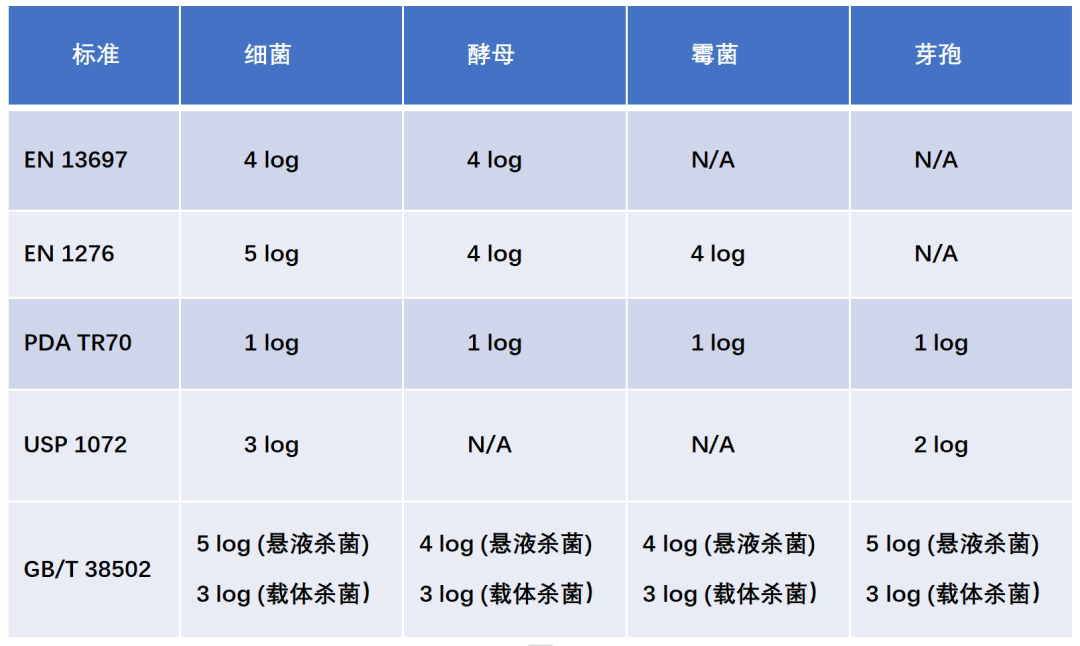
在消毒剂效力验证的评估阶段,可能有如下问题会困扰你?测试菌种的选择消毒剂和测试菌接触时间的选择测试载体材料的选择接受标准的选择
测试菌种的选择
根据PDA TR70计数报告和USP<1072>中说明,在未建立环境菌库且未获得环境分离菌之前,可用ATCC标准菌株(或其它国际菌种保藏中心)作为试验菌。
一般消毒剂效力验证中主要考察细菌、酵母菌、霉菌、芽孢四类,并针对消毒剂类别和微生物控制目标来选取菌株。标准菌株的类型在USP<1072>,中国卫生部2002版《消毒技术规范》,EN 17141:2020《洁净室及其受控环境:微生物污染控制》等不同的标准中均有推荐。
同时,国家药典委员会发布的《药品微生物实验室消毒剂效力评估指导原则公示稿(第二次)》也公布了消毒剂效力评估中的菌种选择指导。
消毒剂和测试菌接触时间的选择
接触时间是消毒剂发挥效力的关键因素。为了达到有效的杀菌、防腐、消毒或杀孢子的效果,需验证所选用产品在表面上停留(润湿)的最短时间。
虽然消毒产品在上市之前都已进行安全检测评价,且已提交消毒效果检查报告,但其主要出于对消毒产品卫生质量安全考量,通常是在较高的接菌浓度和较长的接触时间的实验室条件下,得到的较高水平的杀菌结果。
然而,在洁净实验室实际清洁消毒(喷洒或擦拭等)过程中,在载体表面的消毒剂残留量是有限的;此外,洁净实验室处于持续新风换气,实际能保持有效润湿的接触时间也是有限的,故实际应用中的作用时间无法充分延长。
因此,消毒剂效力验证试验中的接触时间,应模拟实际使用过程,验证最短接触时间。
测试载体的选择
载体杀菌试验是用来检测消毒剂、杀孢子剂降低微生物的水平,需在不用类型的表面材质上模拟。
在实际评估过程中,首先列出所用消毒剂在使用范围中接触到的表面材质,然后根据实际使用情况,评估表面被微生物附着后对最终产品带来风险的大小来选择消毒剂效力验证中的表面载体。
例如:应选择最常见的表面材质、污染物易残留的多孔性载体或者最难清洁的代表材质,如不锈钢、塑料、玻璃、软帘、不同的地板材料(如环氧树脂、乙烯)、墙壁材料(如环氧涂层)等。选择的种类应该考虑是否为关键表面,考虑表面带有微生物后对最终产品带来的风险。
接受标准的选择
USP<1072>DISINFECTANTS AND ANTISEPTICS中指出,消毒剂效力验证必须具有明确的接受标准,实际中建议在接种足量的生物体后,并达到预定的接触时间后,细菌至少减少3 log,芽孢至少减少2 log。
PDA TR70只要从消毒剂注册的要求和内容出发,主要对消毒剂生产厂家提出了较为严苛的接受标准制定的比较严苛:比如在美国生产和销售的消毒剂需要完成美国环境保护署(EPA)注册,并通过美国分析化学家协会(AOAC)指定的标准测试;在欧洲生产和销售的消毒剂需要符合EN检测标准。但PDA TR70对于消毒剂的使用者未提出相同的验证测试要求。
当然,USP 1072也提到除静态阶段形成的孢子外,通常用于实验室测试的对数生长阶段的接种物比来自静态或垂死培养物或环境中受胁迫生物的接种物更具抗性,且在实际生产或操作区域,微生物也可能会在消毒过程中被物理除去。因此使用实验室试验菌进行消毒剂效力验证的测试方法更为严苛,进而证明产品的有效性。
综上,在药品、生物医药、医疗器械行业,考虑到在受控的生产环境中其生物负荷水平较低,接受标准可参考合适标准进行选定,一般可参考USP 1072指定的接受标准。
上海医药实验室可提供服务
我们的服务包括三个方面,具体如下:消毒剂验证方案制定:协助客户制定符合法规要求的验证方案杀菌效果试验:包括中和剂验证,悬液杀菌试验和载体杀菌试验验证报告出具:提供详细的验证报告,包括测试结果和结论。
实验室测试经验
拥有丰富的消毒剂测试经验,包括但不限于:75%酒精70%异丙醇(IPA)6%过氧化氢酸酚碱酚杀孢子剂复核过氧乙酸新洁尔灭季铵盐等
通过这些服务和经验,实验室能够为客户提供全面、专业的消毒剂验证服务,确保药品生产环境的洁净与安全。
关于华测医药-药品检测服务
华测医药-药品检测服务(上海华测品创医学检测有限公司),隶属华测检测集团旗下全资子公司之一,拥有化学实验室、微生物实验室、生物实验室与支原体实验室等技术平台,实行CNAS和GMP双体系运行,兼具CNAS和CMA资质。
服务涵盖原料药、活性配料、制剂、包装材料和医疗器械等产品,可以提供各类化学分析、微生物分析、生物安全性分析和包材相容性研究等多领域研究和检测服务。
参考文献
1.国家药品监督管理局食品药品审核查验中心.药品GMP指南:无菌制剂上册[M].20232.Parenteral Drug Association.PDA Technical Report No.70(TR 70)Fundamentals of Cleaning and Disinfection Programs for Aseptic Manufacturing Facilities[M].2015
能力验证的目的
能力验证是指利用实验室间比对来确定实验室检测/校准能力的活动。它是确保实验室维持较高的校准和检测水平而对其能力进行考核、监督和确认的一种验证活动。参加能力验证计划,可以为实验室提供评价其出具数据可靠性和有效性的客观证据。
2022-05-19 05:34:17
防疫抗疫 | 如何使用是关键,别让“消毒液”变“毒液”
期,奥密克戎新冠病毒再次反扑国内各大城市,面对疫情,除了尽量在家隔离减少与人接触以及出门戴口罩之外,消毒液的使用也很必要。 消毒液的种类繁多,不同类型消毒液使用注意事项皆不同,如何“正确使用”是非常重要的。下面我们就将与疫情相关的消毒液使用注意事项做一介绍。
2022-03-21 08:06:12
CTI华测4月能力验证计划火热报名中
为满足广大实验室对各种类别能力验证活动的需求,2022年CTI华测检测推出十二大领域能力验证项目(详见二维码中计划表),同时CTI华测检测将继续常年开展测量审核项目,并接受定制的能力验证项目的委托,接受客户委托制备符合实验室需求的标准物质/标准样品。
2022-03-16 05:44:59
- 热线电话
- 业务咨询
- 快速询价
- 在线客服
- 报告验证