文献解读 | 融合蛋白组学特征揭示食管胃交界腺癌:分子层面剖析癌症
食管胃交界腺癌(adenocarcinoma of esophagogastric junction,AEG)是指发生在食管胃解剖交界线上下5 cm区域的腺癌。每年有超过150万病人患有此病。
根据Lauren分类,AEG以肠型最常见,胃食道反流病(GERD)引起的肠化生是AEG的主要危险因素。目前,包括手术切除、化疗和免疫治疗在内的综合治疗是治疗AEG最有效的方法。
然而,大多数AEG患者在确诊时有局部晚期肿瘤或远处转移,不符合手术条件。靶向治疗仅适用于晚期转移性HER2阳性肿瘤患者,受益人群非常有限。
随着PD1/PD-L1抑制剂的使用,AEG的免疫治疗取得了重大进展。然而,由于免疫微环境的异质性和复杂性,免疫治疗仍面临许多挑战。因此,有必要更好地了解AEG致癌的分子机制,并确定潜在的预后指标和药物靶点。

01研究目的
AEG横跨胸腔和腹腔两大解剖区域,又具有不同于食管和胃的组织学特征,在流行病学、病因学和病理特征上均不等同于食管和胃癌。近几十年来,食管胃交界部腺癌(AEG)的发病率迅速上升,但其分子改变和亚型尚不清楚。
02研究方法
该研究采用多组学联合分析方法,对103个AEG肿瘤和配对的正常邻近组织(NAT)进行了蛋白质组学和磷酸蛋白质组学分析,对94个肿瘤-NAT对进行了整个外显子组测序,并对83个肿瘤-NAT对进行了RNA测序。
03研究结果
(1)AEG肿瘤样本的分子图谱
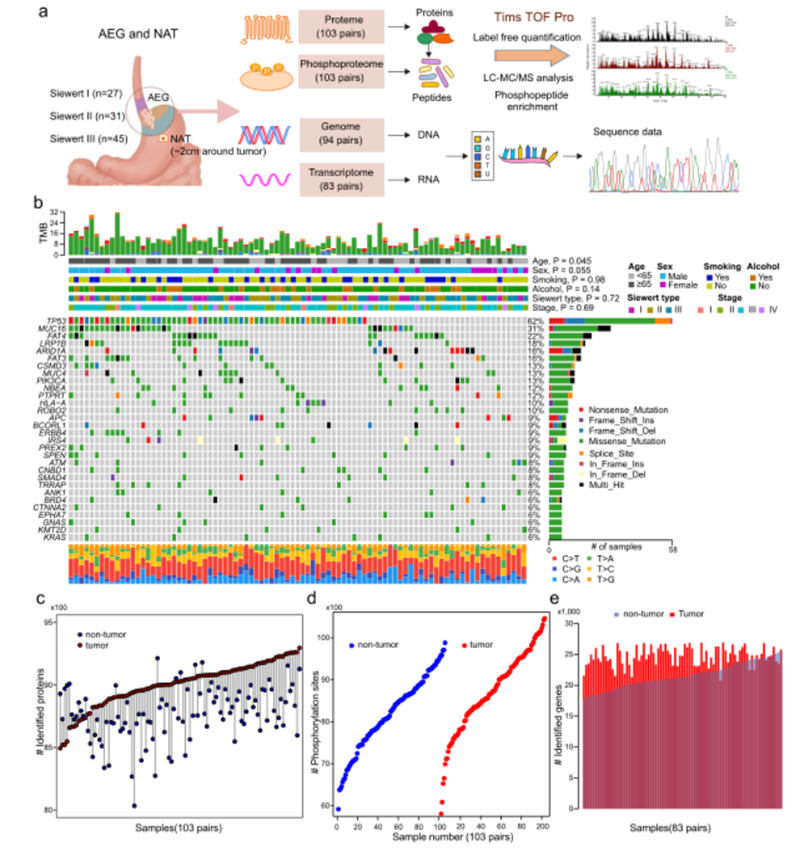
图1,AEG肿瘤样本的分子图谱
为了表征AEG肿瘤的全面分子景观,作者对103名患者的配对肿瘤和NAT样本应用了多组学分析,包括蛋白质组学分析、磷酸化蛋白质组学分析、WES和RNA-seq(图1a)。
在目前的AEG队列中,最常见突变的癌症相关基因是TP53(62%)、MUC16(31%)、FAT4(22%)、LRP1B(18%)、ARID1A(16%))和FAT3(16%)(图1b)。
从103例AEG患者的206个蛋白质组和磷酸蛋白质组中,平均鉴定出8885个蛋白质(图1c)和8445个磷酸化位点(图1c)。从RNA-seq数据中发现,在166个AEG肿瘤和NAT样本中平均有23,131个基因表达(图1e)。
总体而言,明显更多的蛋白质、磷酸化位点和基因在AEG肿瘤中的检测结果高于在NAT样本中的检测结果。这一观察结果表明,与NAT相比,AEG肿瘤可能表现出异常较高的分子活性。
(2)AEG肿瘤的蛋白质组学特征
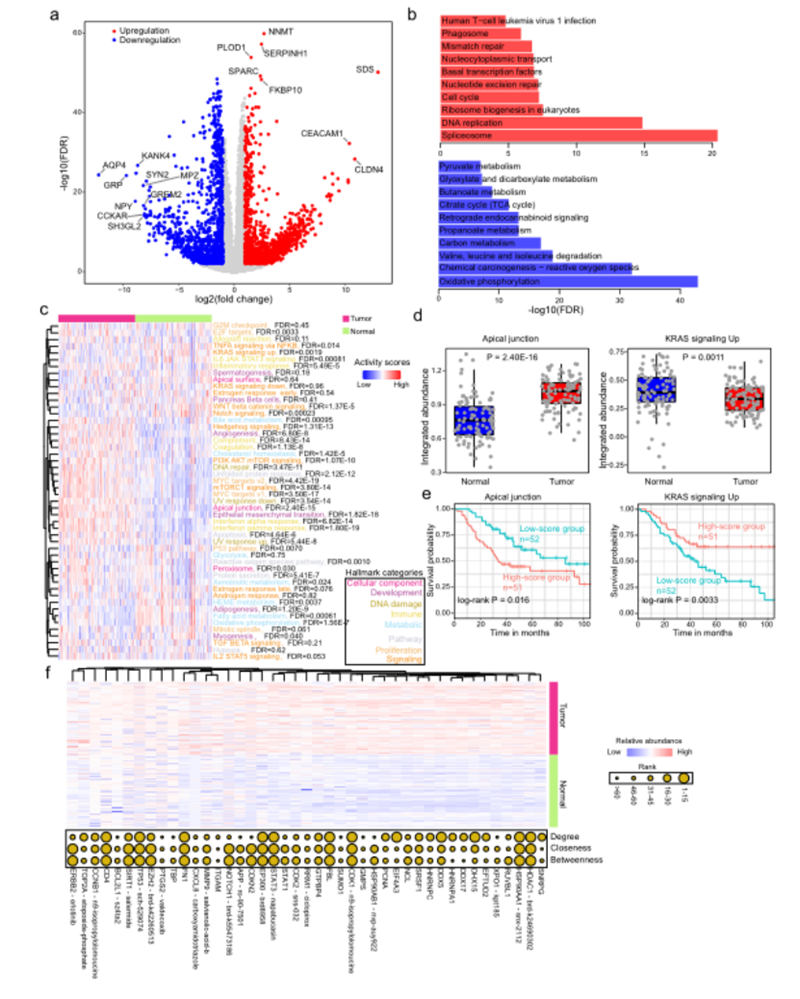
图2,AEG肿瘤中的蛋白质组变变化
差异蛋白分析显示,与配对的NAT样本相比,AEG肿瘤样本中有2,300个上调蛋白和1667个下调蛋白(图2a)。
上调的蛋白显着富集于基因组调控和不稳定相关的生物过程,如“剪接体”和“DNA复制”,而下调的蛋白则更富集于代谢相关的过程,如“氧化磷酸化”和“碳代谢”(图2b)。
此外,还评估了每个样品中五十个标志性生物过程的总体蛋白质水平整合丰度。大多数标志(50个中的36个,72%)显示配对肿瘤和NAT样本之间显着不同的整合丰度(图2c)。
例如,“心尖连接”标志基因集显著上调,而“KRAS信号上调”标志基因显著下调(图2d)。“心尖连接”标志基因的较高整合丰度表明AEG患者的预后较差,而“KRAS信号传导”的较高整合丰度表明AEG患者的总生存时间较长(图2e)。
为了进一步优化候选蛋白质列表,我们绘制了前50个DEP与具有最大程度、最接近或最中间的前50个蛋白质的图谱,其中一些也被发现是已知抗癌化合物的靶标,如HDAC1、HSP90AA1和TP53(图2f)。
该分析全面展示了AEG肿瘤的蛋白质组学改变,并进一步研究了它们的功能和分子代谢,并可能为这种疾病提供有效的药物靶点。
(3)基于蛋白质组学的AEG肿瘤亚型
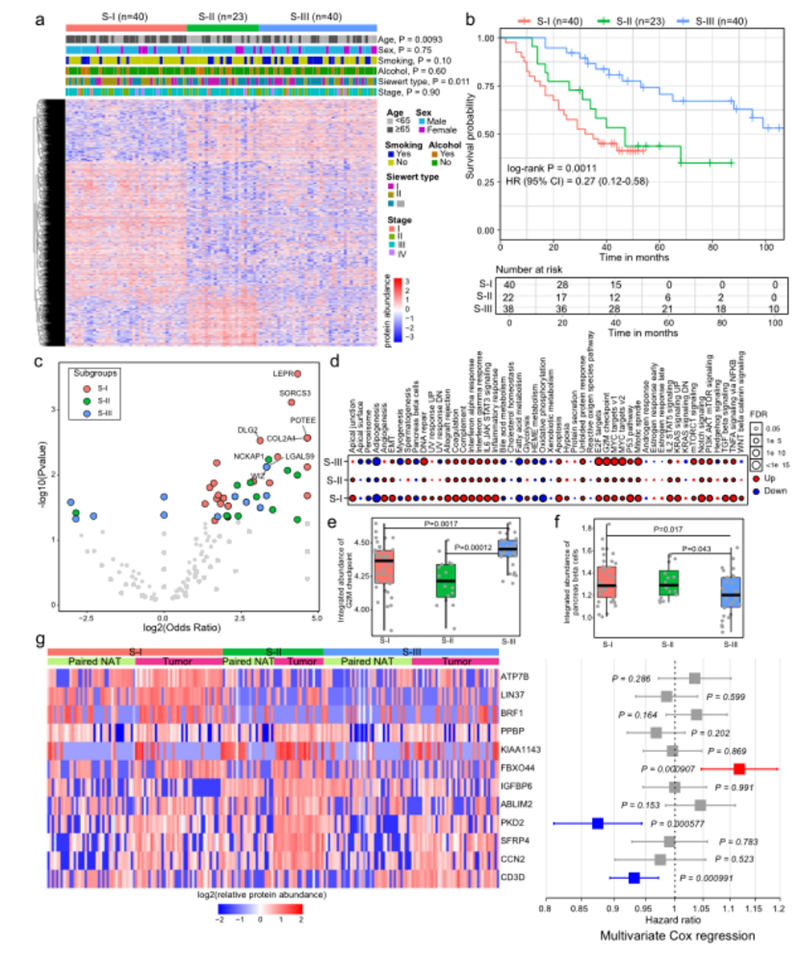
图3,AEG肿瘤的蛋白质组亚型
肿瘤样本之间的蛋白质组异质性激发作者根据蛋白质组数据探索AEG亚型。采用NMF算法通过蛋白质组学数据对AEG肿瘤样本进行聚类。
鉴定出三种不同的亚型,其中S-I亚型40个样本,S-II亚型23个样本,S-III亚型40个样本(图3a)。这三种亚型的患者表现出显着不同的总生存时间,其中S-III患者的生存时间最长,S-I患者的生存时间最短(图3b)。
接下来,比较了这三种亚型之间的基因突变频率,发现S-I、S-II和S-III亚型分别有97、143和29个特异突变基因(图3c)。
尽管肿瘤样本在所有亚型中都表现出标志性整合蛋白丰度的失调,但S-II亚型中的样本显示出变化程度降低(图3d)。
例如,S-III亚型中“G2M检查点”标志的综合丰度显着高于其他两种亚型,而“胰腺β细胞”在S-III亚型中的水平明显较低(图3e f)。
其中,12个特征蛋白在单变量Cox回归分析中显示与患者生存时间显着相关(图3g)。总之,蛋白质组学分析确定了三种不同的AEG亚型,它们表现出分子和临床差异。
(4)FBXO44促进AEG肿瘤进展和转移
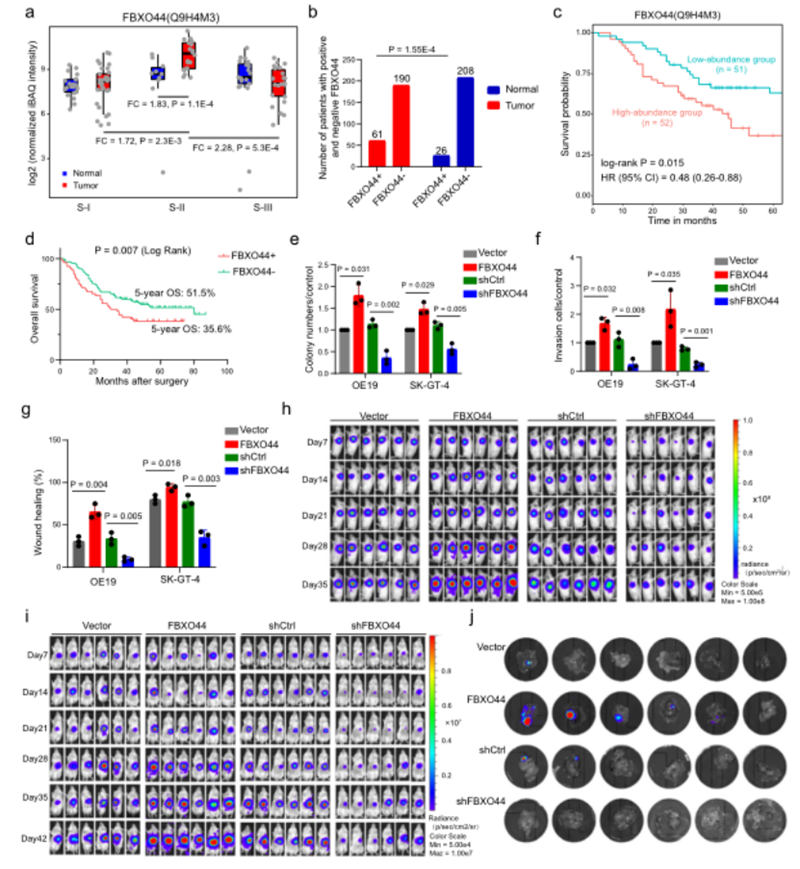
图4,FBXO44的临床相关性和生物学功能
FBXO44是F-box蛋白家族的成员,已被证明在人类癌症中发挥作用。
TCGA队列中18种不同肿瘤类型中的8种中FBXO44基因显示出显着失调。FBXO44蛋白在S-II AEG肿瘤样本中的丰度显着高于S-II正常样本、S-I肿瘤样本和S-III肿瘤样本(图4a)。
肿瘤样本中FBXO44蛋白的上调在251名AEG患者的独立临床队列中得到了进一步验证(图4b)。在这两个队列中,FBXO44高表达的AEG患者的生存时间显著短于低表达FBXO44的AEG患者和另一个独立的临床队列的251名AEG患者(图4c d)。
为了进一步证实FBXO44在AEG中的作用,我们在两种不同的AEG细胞系OE19和SK-GT-4中进行了FBXO44的过表达(OE)和敲低(KD)。在OE19和SK-GT-4细胞中,FBXO44 OE促进细胞增殖1.79倍和1.4 8倍,细胞侵袭增加1.68倍和2.18倍,细胞迁移能力增强2.13倍和1.18倍(图4e f g)。
相反,FBXO44敲除抑制了68.1%和49.1%的细胞增殖,细胞侵袭减少79.3%和70.9%,细胞迁移减少71.8%(图4e f g)。
我们观察到,FBXO44 OE使AEG异种移植肿瘤的生长增加了2.54倍,而FBXO44 KD在体内抑制了肿瘤生长67.17%,在OE 1 9正交A EG小鼠模型中也观察到类似的结果(图4g I j)。
总之,我们的分析表明,高水平的FBXO44表达与AEG患者的不良预后相关,并促进AEG肿瘤细胞在体外和体内的生长和转移。
(5)不同AEG亚型之间的基因组差异

图5,三种蛋白质组亚型之间基因组特征的比较
在AEG亚型中分别提取突变特征。这三个亚型表现为S与S的共享性和特异性。
特别是,S-I和S-II共享SBS3签名,这表明通过同源重组(HR)修复DNA双链断裂(DSB)中的缺陷。S-II和S-III两个亚型都显示出代表缺陷DNA错配修复的SBS6突变特征(图5b和图5c)。
SBS17b突变特征被S-I和S-III亚型所共有,显示出T>G核苷酸替换的独有高频(图5a c)。S-II亚型独有的APOBEC胞苷脱氨酶突变特征(SBS2特征)(图5b)。
在S-III亚型中特异性地检测到“由于NTHL1的失活突变导致碱基切除修复缺陷”的突变特征(SBS30特征)(图5c)。
为了进一步描述亚型特有的基因组特征,作者分别在不同的AEG亚型中进行了体细胞互作分析。我们在S-I、S-II和S-III亚型中分别发现了21、12和19对共现突变基因(图5d-f)。
特别是,CSMD1和ANKRD36C基因在S-I AEG肿瘤亚型患者中显示出显著的突变共存(图5d)。MUC4和CPED1基因的共存突变在S-II亚型中被明确鉴定(图5e)。
FAT4和PRKDC基因突变在S-III亚型的AEG患者中表现出显着的共现性。
此外,RYR2和TTN被发现仅在S-III AEG亚型中发生突变(图5f)。此外,还对AEG肿瘤中已知的致癌途径进行了检查。所有亚型中最常见突变的致癌途径是“TP53”、“RTK-RAS”和“Hippo”途径(图5g)。
尽管在超过一半的个体亚型样本中发现了“RTK-RAS”通路中的基因突变,但不同亚型中受到影响的基因组明显不同(图5h)。
总之,AEG亚型显示出明显可区分的基因组特征,这可能表明不同的病因机制和针对各个亚型的精确治疗。
(6)AEG肿瘤中的免疫浸润
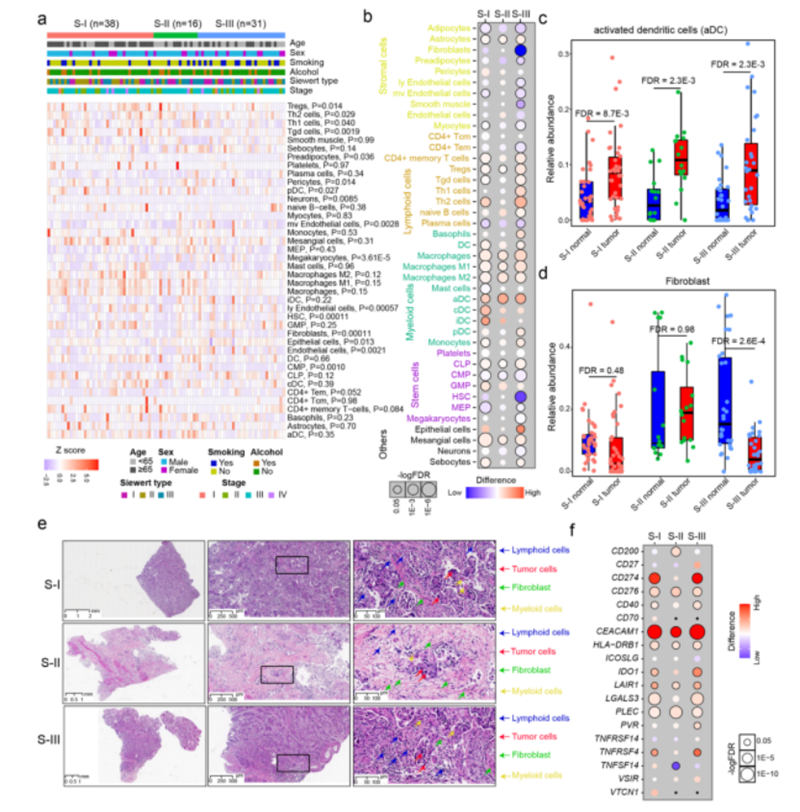
图6,不同蛋白质组亚型的免疫浸润
一些细胞类型的浸润在三种AEG亚型之间表现出显着差异,例如调节性T细胞和成纤维细胞,但它们与AEG患者的临床病理特征没有关联(图6a)。比较每个亚型的肿瘤和NAT样本之间的细胞丰度揭示了不同细胞类型的细胞丰度的普遍变化(图6b)。
例如,所有三种AEG亚型的肿瘤样本中激活的树突状细胞(aDCs)的丰度均显着增加(图6c)。成纤维细胞丰度在S-III型中显著降低,而在S-I和S-II亚型的肿瘤标本中无明显变化。(图6D)。
与S-I和S-II亚型的样本相比,我们的HE分析还显示S-III亚型的成纤维细胞丰度降低(图6E)。一些免疫检查点,例如CEACAM1、CD276、PLEC、HLA-DRB1和LAIR1,在所有三种亚型中均持续上调(图6f)。
总之,作者的分析揭示了肿瘤微环境浸润和免疫检查点的异质性,这为AEG患者提出了潜在的常见和亚型特异性免疫治疗策略。
(7)AEG肿瘤的磷酸化蛋白质组学特征
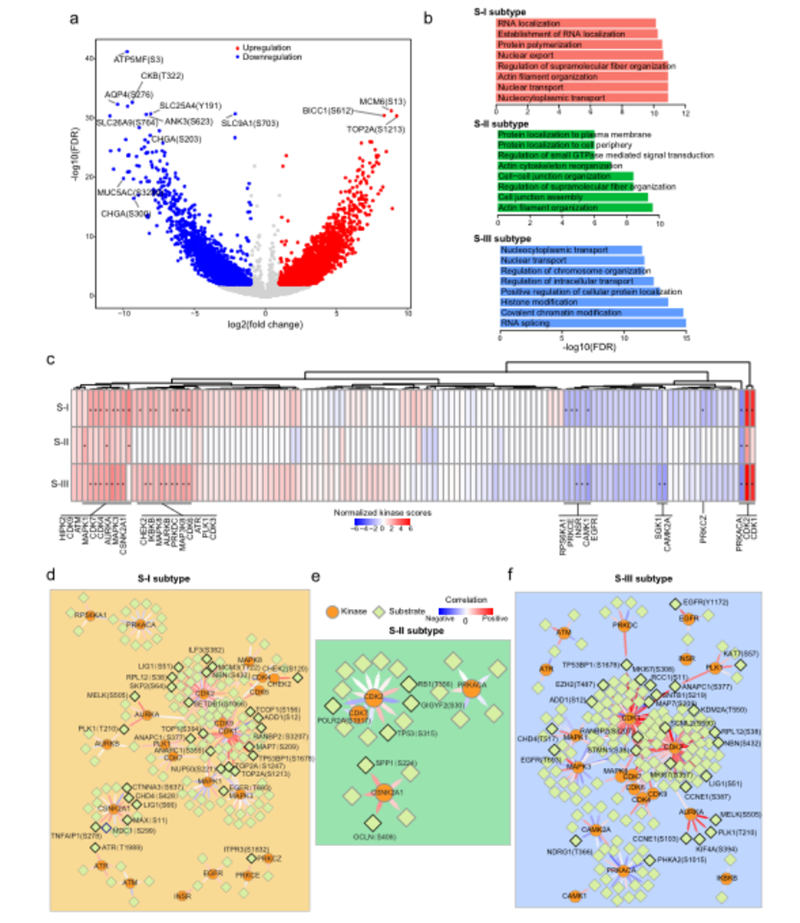
图7三种AEG亚型的磷酸化蛋白质组学分析
差异磷酸化分析确定了肿瘤样本中4932个磷酸化增加的位点和3146个磷酸化减少的位点(图7a)。
S-I和S-II亚型中差异磷酸化的蛋白质在核运输和细胞组织中富集,而S-III亚型中的染色质修饰和组织非常丰富(图7b)。然后根据每个AEG亚型中差异磷酸化位点解释激酶活性。进行激酶底物富集分析以检测不同亚型中富集的激酶。
不同的AEG亚型富含不同的激酶列表,相同的激酶在S-I、S-II或S-III亚型中表现出不同水平的活性(图7c)。在三种AEG亚型中基于已知激酶磷酸底物对的相关性,我们分别构建了激酶-磷酸底物调控网络(图7d-f)。
CDK2在S-I和S-III亚型中与18和28种磷酸底物表现出显着的正相关性,而在S-II亚型中没有检测到显着的相关性(图7e)。
最后,作者的分析揭示了不同亚型之间激酶-磷酸底物调节网络的差异,并提出了对AEG患者临床治疗的潜在个性化反应。
04 研究结论
该研究分析揭示了AEG肿瘤中蛋白质组的广泛改变和252种潜在的可药物蛋白。我们确定了三种具有显着临床和分子差异的蛋白质组亚型。S-II亚型特征蛋白FBXO44已被证明可在体外和体内促进肿瘤进展和转移。
我们的比较分析揭示了AEG亚型的独特基因组特征。我们发现S-III亚型中成纤维细胞的特定减少。进一步的磷酸蛋白质组比较揭示了AEG亚型之间不同的激酶-磷酸底物调控网络。我们的蛋白质组学数据集为了解AEG的分子机制和制定精准治疗策略提供了宝贵的资源。
05 总结与启发
通过这种整合性分析,研究人员发现了大量蛋白质表达的改变,其中部分具有生物学功能、信号通路关联和预后潜力。
从研究结果中,筛选出几个对食管胃结合处腺癌具有重要意义的蛋白质,包括炎症、细胞骨架、DNA修复、代谢等方面的关键参与者。
此外,研究还揭示了具有额外生物学活性的磷酸化位点,此类位点在食管胃结合处腺癌样本中发生改变,表明磷酸化对这一癌症的生物学功能具有重要影响。这些发现有助于更全面地了解食管胃结合处腺癌的生物学特性,拓展潜在治疗靶点,以帮助改善诊断和治疗手段。
06 科研服务:蛋白质组磷酸化修饰
华测艾研多组学研究中心为您提供蛋白质组磷酸化修饰检测服务,揭示生命奥秘!
作为细胞生命活动中的关键调控因素,蛋白质磷酸化修饰对于生命科学研究具有极其重要的意义。不论是信号传导、细胞周期调控还是疾病发生、药物靶点探索,磷酸化修饰都密切相关。
为什么选择我们
● 提供全面、高效、专业的蛋白质组学磷酸化修饰检测服务;
● 针对多样的蛋白质样本,有效识别磷酸化位点,提供准确、可靠、量化的数据支持。
● 配合尖端科学仪器和技术,开启发现新靶点、揭示生物调控机制的研究之门。
● 只要一步,我们就能为您提供从样品准备到数据分析的全套解决方案!立即联系我们,让您的研究事半功倍,开启蛋白质组学磷酸化修饰检测的新篇章!
参考文献
Li S,Yuan L,Xu ZY,Xu JL,Chen GP,Guan X,Pan GZ,Hu C,Dong J,Du YA,Yang LT,Ni MW,Jiang RB,Zhu X,Lv H,Xu HD,Zhang SJ,Qin JJ,Cheng XD.Integrative proteomic characterization of adenocarcinoma of esophagogastric junction.Nat Commun.2023 Feb 11;14(1):778.doi:10.1038/s41467-023-36462-8.
【精彩回顾】华测艾普受邀参加北方结直肠肿瘤整合医学论坛
4月8日,华测艾普医学检验所受邀参加北方结直肠肿瘤整合医学论坛会,在北京整合医学学会的领导和支持下,依托国家癌症中心/中国医学科学院肿瘤医院,中国医学科学院肿瘤医院结直肠外科发起并成立北京整合医学学会结直肠肿瘤分会和经自然腔道取标本手术(NOSES)分会,来自京、津、冀、晋、蒙五省市地区从事结直肠肿瘤专业的区域医疗中心、市级医疗中心的400余位中青年骨干热情参加本次大会,涵盖了外科、肿瘤内科、放疗科、影像、病理等领域。
2023-05-12 07:10:01
4月全球消费品(除玩具、电器及纺织品)召回案例分析
2022年4月,欧盟Rapex系统共召回114例消费品(除玩具、电器及纺织品),1例产自新西兰,1例产自荷兰,2例产自美国,1例产自奥地利,1例产自意大利,1例产自保加利亚,1例产自葡萄牙,1例产自土耳其,5例产自波兰,1例产自拉脱维亚,2例产自法国,1例产自英国,49例产地未知,其余产自中国大陆。
2022-05-30 07:11:43
免疫力|带你了解可以防御“外敌“的免疫基因
免疫力是人体自身的防御机制,可以识别和消灭外来侵入的任何异物(病毒、细菌等),是处理衰老、损伤、死亡、变性的自身细胞和病毒感染细胞的能力。在人体受到外来物刺激之后,免疫系统会被激活,各种免疫相关调控因子介入,使得人体尽快恢复内环境稳定。
2022-05-09 07:53:05
- 热线电话
- 业务咨询
- 快速询价
- 在线客服
- 报告验证

.jpg)
.jpg)
.jpg)

