文献解读 | 探究小鼠肝脏发育成熟过程:单细胞转录组揭示细胞变化
肝脏在体内执行重要代谢功能,包括新陈代谢、解毒、胆汁分泌和血浆蛋白的产生。
小鼠的肝脏发育从胚胎的E8.5-9.0开始,由前肠腹壁的原代肝芽生长,来自中胚层中的成纤维细胞生长因子(FGFs)和横隔间充质(STM)的骨形态发生蛋白(BMP)的协同活动驱动的。到E9.0时,实质祖细胞从芽中分层并侵入周围的STM,可以分化成肝细胞和胆管细胞,即胆道上皮。随后分化,最终形成肝脏器官。

近年来,对肝脏的细胞类型和发育过程有一定研究进程,单细胞RNA测序已被用于表征小鼠肠道内胚层和原肠胚的形成,表明了肝脏发育的开始。但目前对肝脏的全部细胞类型以及出生后的肝脏发育过程还存在认知盲区。
在本研究中,对所有主要的肝细胞类型进行分离,在单细胞的分辨率下全面对小鼠出生后的肝脏发育进行解读。
01研究目的
本研究利用单细胞转录组学技术,旨在揭示肝脏细胞的异质性,确定肝细胞发育过程中的候选调节因子及其在肿瘤形成过程中可能的作用。
02研究方法
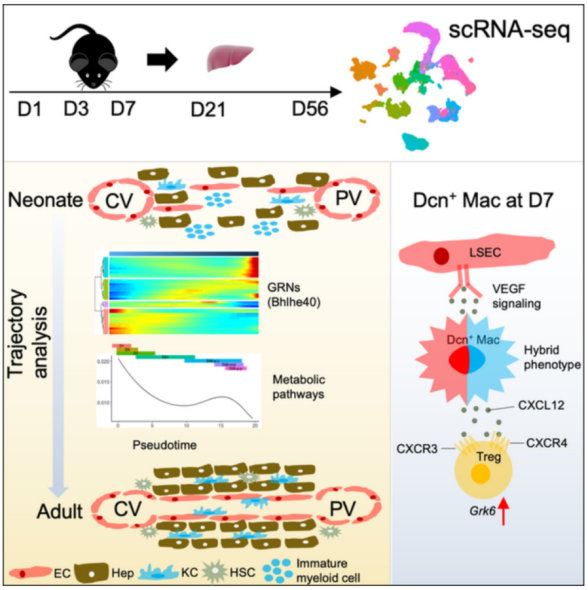
选取出生后第1、3、7、21和56天的小鼠肝脏细胞进行单细胞转录组测序,构建了小鼠从出生到成熟整个肝脏发育时期的单细胞转录组图谱。
03研究结论
1.出生后早期肝脏中肝细胞的异质性
对测得的52834个细胞进行UMAP分类,并注释成31个簇,其中包括肝细胞(来自D1,D3和D7的肝新生儿;Hep-D21;Hep-D56),内皮细胞(EC),肝星状细胞(HSC),胆管细胞,成纤维细胞,间皮细胞(中观),巨核细胞,红系细胞(前成红细胞,成红细胞,红细胞),T细胞,自然杀伤(NK)细胞,B细胞(Pro-B,大前B,小前B,B),树突状细胞(经典树突状细胞1—cDC1,经典树突状细胞2—cDC2,浆细胞样树突状细胞—pDC,活化树突状细胞—aDC),单核细胞,DCN巨噬细胞(DcnMac),Kupffer细胞,中性粒细胞(未成熟中性粒细胞—iNP,中间成熟中性粒细胞—imNP,成熟中性粒细胞—mNP),嗜碱性粒细胞,粒细胞—单核细胞祖细胞(GMP)和造血祖细胞(HPC)。
相对于D21和D56细胞,D1、D3和D7的肝细胞更为聚集,且高表达肝母细胞或肝细胞癌(HCC)标志物,如Afp,Ahsg和H19,且Mki67的表达很高。表明肝细胞增殖能力比较强。
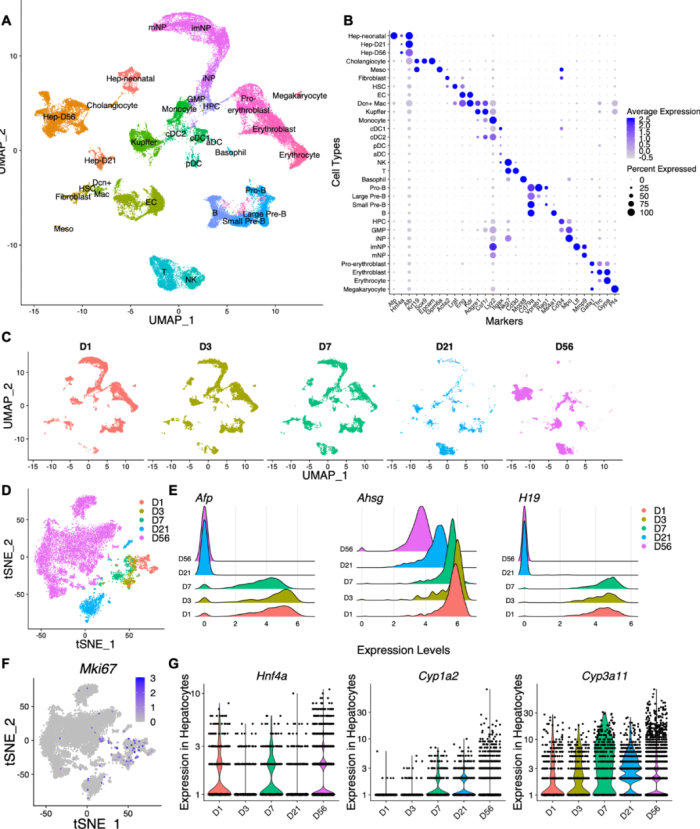
图1发育和成熟肝脏的单细胞图谱
对各个时间的肝细胞进行重聚类,鉴定出2-3个亚群,在不同的时间共享同样的标记基因。脂肪酸代谢的关键酶Scd1在D21和D56处高表达,而Scd2主要在D1表达,qPCR结果一致。
在D21和D56发现了两个罕见的肝细胞亚群,Hep2细胞的特征是Neat1,Malat1和Mlxipl的高表达,Neat1和Malat1代表了细胞核中最丰富的lncRNA,而Mlxipl是为数不多的显示核保留的主要剪接聚腺苷酸化蛋白质编码mRNA之一,Malat1与线粒体RNA比例和细胞死亡有关。
2.沿小叶轴建立分区模式
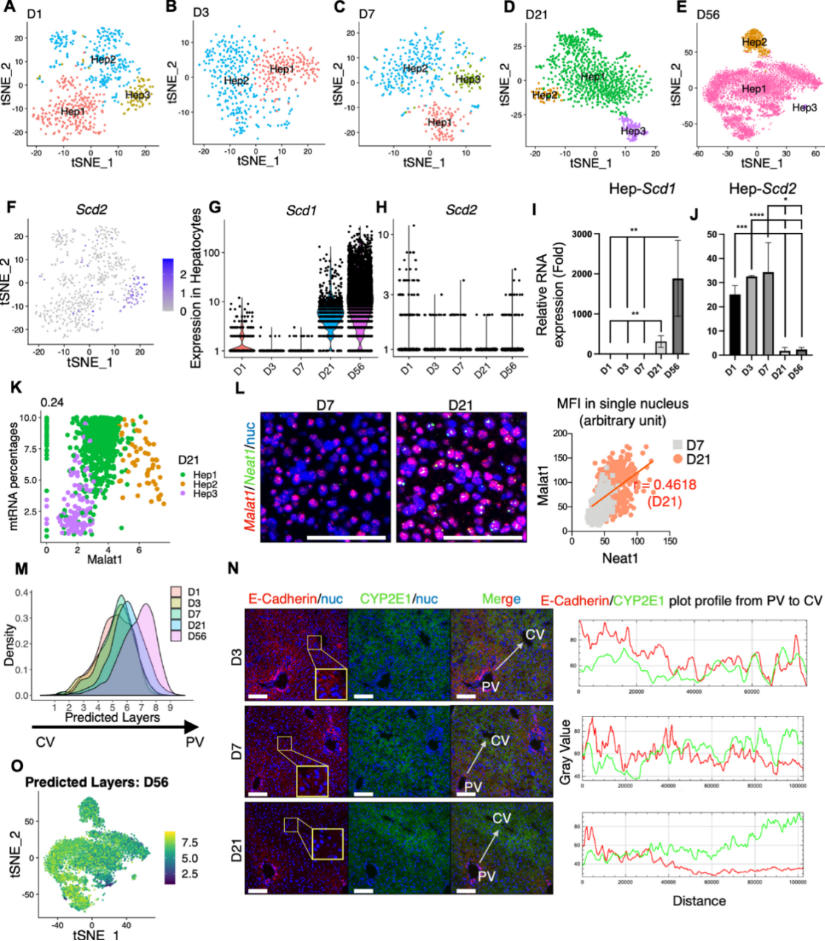
图2每个时间点肝细胞图谱异质性
之前研究将肝小叶分为九层,在本研究中通过计算推断了肝细胞簇中每个细胞的空间位置。第一层代表CV区域中的肝细胞,第九层靠近PV。D56与成人肝脏分区模型一致,密度达到峰值。热图显示出D1到D56逐步区分CV到PV的转变,以及转录组显示D21肝细胞中代谢区尚未发育完全,只有在D56处才能区分。
使用Monocle进行拟时序分析,结果显示,在D56处,首先出现中心周围肝细胞(D56-p.c.)随后是小叶中(D56-mid),之后是门脉周(D56-p.p),门静脉周围肝细胞功能成熟较晚。
3.识别肝脏发育过程中的转录因子和代谢发展
研究者对拟时序中每个时间点鉴定差异表达基因,通过通路富集分析,在cluster1中鉴定出外周生物钟相关途径,相关基因从D1-D56逐步增加。
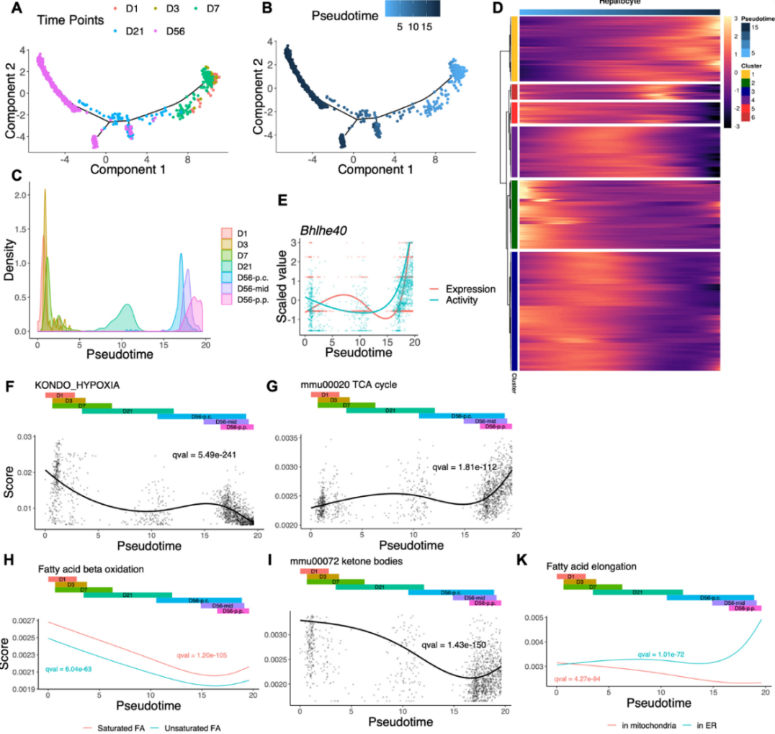
图3 肝细胞转录因子和代谢功能的动态变化
使用SCENIC对差异基因进行转录因子分析,捕获36个转录因子都表现出伪时间的显著变化,例如Bhle40。根据伪时间,对细胞进行排序,并提取显著变化的基因集,进行通路富集分析,结果包括缺氧相关途径、三羧酸循环、脂肪酸β氧化、酮体相关的途径、胆固醇生物合成的甲戊酸途径。
4.肝脏内皮细胞和间充质细胞的发育
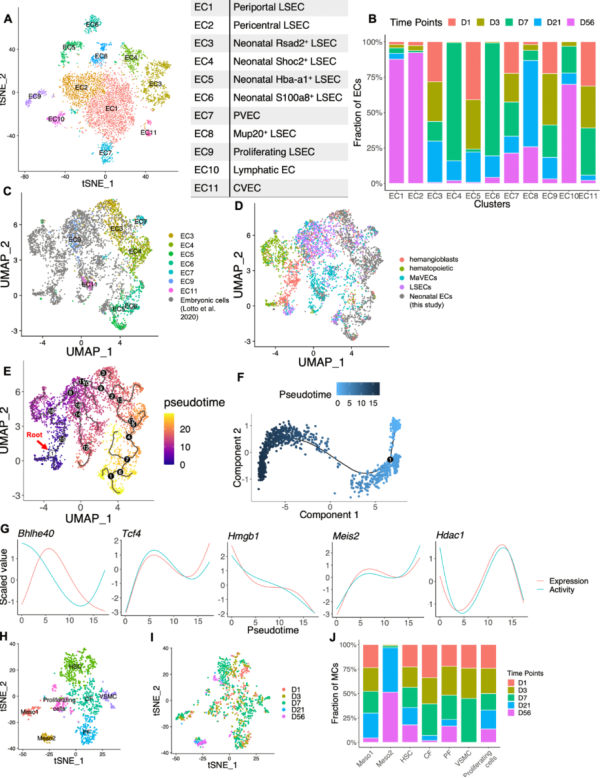
图4 肝脏内皮细胞和间充质细胞的发育
肝内皮细胞(EC)由大血管内皮细胞(MaVEC)、淋巴内皮细胞和肝窦内皮细胞(LSEC)组成。对EC重聚类和细胞鉴定,分为11个亚群,且所有时间点都能检测到一小群EC9细胞,表达增殖和细胞周期相关的基因,表明在发育中的肝脏维持了具有增殖潜力的LSEC池。
随后,构建了胚胎和新生儿内皮细胞数据的发育轨迹,揭示了E7.5到D7的发育过程。根据表达模式,进行富集分析,结果表明在出生后表达降低的基因中检测到VEGFA-VEGFR信号通路、糖酵解和缺氧途径,表明LSEC在出生后经历与肝细胞类似的代谢变化。同时,在表达上调的基因中,发现了多个发育相关的转录因子。
间充质细胞是肝损伤后肌成纤维细胞的来源,在此研究中,对间充质细胞也进行重聚类分析,发现Meso1和Meso2两个亚群,其中Meso1主要由新生儿阶段的细胞构成,Meso2在D21和D56处取代Meso1。
5.造血和免疫细胞的动态变化
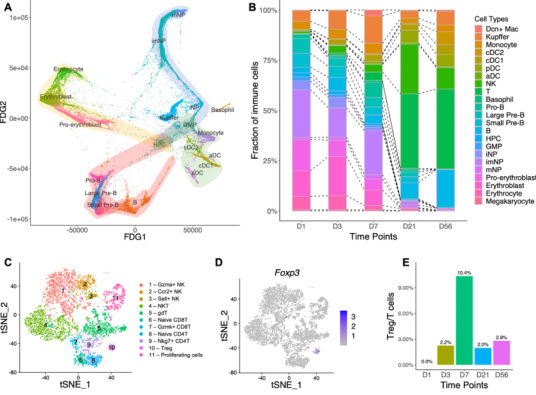
图5 造血和免疫细胞的动态变化
对处于发育中的造血细胞进行轨迹分析,可以分为造血祖细胞(HPC)、粒细胞-单核细胞祖细胞(GMP)、B细胞、中性粒细胞和红系谱系。HPCs与三条主要路径相连,向GMP,红系谱系和B细胞发展,GMP产生单核细胞和中性粒细胞。
肝造血在出生后持续存在,但在D7后几乎无法检测到。在出生后肝脏中未观察到T细胞和NK细胞的发育,随着时间的推移,T细胞和NK细胞以及树突状细胞(DC)的比例逐渐增加,表明它们在出生后从胸腺或骨髓中迁移到肝脏。
Treg细胞随着时间推移呈现出独特变化,在D7处出现峰值,肝脏中有Treg细胞的积累,与之前研究一致。随后比较了D7、D21和D56在Treg细胞中的差异表达基因,发现可能与细胞增殖有关。
6.独特的巨噬细胞亚型在D7短暂出现
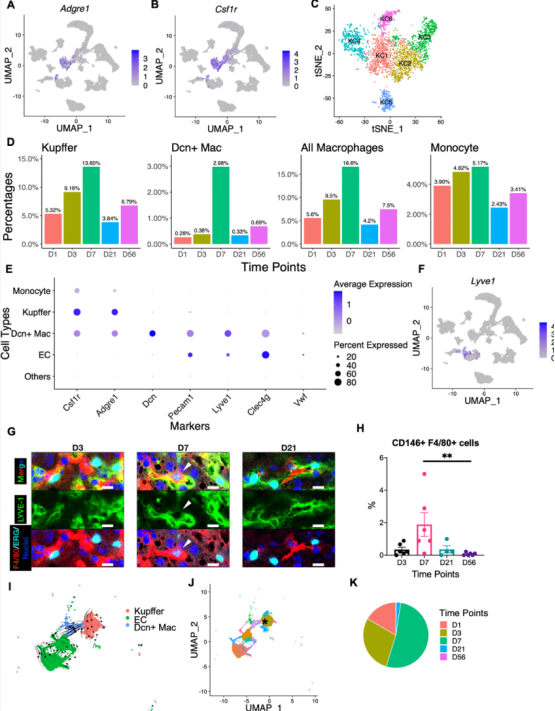
图6 巨噬细胞亚型在D7处短暂出现
对肝脏巨噬细胞进行重聚类,确定了6种巨噬细胞亚型,具有不同的基因表达谱和TF活性。并鉴定了一个巨噬细胞亚群(Dcn+Mac),该亚群表达内皮细胞、巨噬细胞的marker基因,而几乎所有的Dcn+巨噬细胞都出现在D7。
而免疫荧光和RNA速率分析显示Dcn+Mac来自Kupffer细胞而不是ECs,过渡点处的Kupffer细胞(星号标记)在D1、D3和D7中有发现,显示了新生小鼠时期的分化潜能。过渡KCs主要来源于KC2,高表达Pou2f2和Tcf7l2的转录活性,这可能驱动KC2向Dcn+Mac细胞转变。
7.肝细胞和鼻咽癌间细胞间通讯
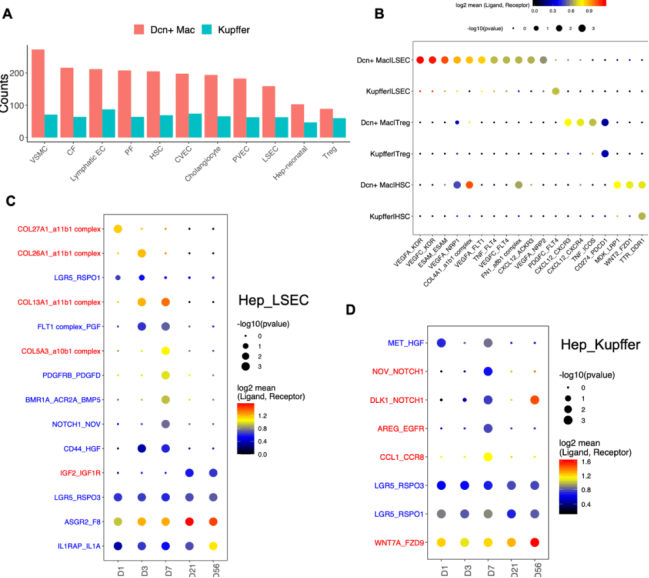
图7 预测肝细胞间相互作用
针对巨噬细胞亚型DCN+Mac细胞,研究者通过CellPhoneDB进行配体受体分析,确定了与DCN+Mac细胞可能互作的细胞类型,包括HSC、成纤维细胞、间皮细胞、胆管细胞、VSMC和内皮细胞的所有亚型。
之后研究了肝细胞和NPC之间的作用,以及出生后早期细胞间信号传导的动态变化,研究者分别对所有五个时间点进行配体受体分析。发现LSEC和肝细胞之间的RSPO1/3-LGR5相互作用.RSPO3-LGR5在所有时间点均显著表达,而RSPO1-LGR5仅在新生儿期发现。
RSPO与存在于中央周围肝细胞上的LGR5的结合促进了Wnt信号传导,其调节了中心周围区域的分区代谢活动。几乎所有与肝细胞密切相关的细胞类型,与其他时间点相比,最活跃的串扰发生在D7,揭示了出生后肝脏中的一个关键时间点D7,涉及许多分子和细胞活动以及通讯。
04总结与启发
这项研究提供了肝脏发育的蓝图,展示新生儿肝脏如何发育成主要的代谢器官,描述单细胞分辨率下的逐步变化。轨迹分析显示肝细胞和LSEC在代谢区构建过程中的逐步协调发育和功能成熟。肝细胞类型间的相互作用显然参与了早期阶段的协调发育过程。
值得注意的是,在D7处发现了一组巨噬细胞,其表现出巨噬细胞和内皮细胞的杂交表型。细胞间相互作用分析表明,Dcn+Mac在调节正弦血管形成和Treg细胞中具有假定的作用。
05产品推介:单细胞转录组测序
单细胞转录组是一种先进的基因测序技术,通过对单个细胞进行基因测序,可以深度了解单个细胞的表达谱和基因调控网络,为研究不同细胞类型、特征和功能提供极大帮助。华测艾研多组学研究中心——为您提供单细胞转录组检测服务:
为什么选择我们:
● 高灵敏度-可以检测到低表达基因;
● 高通量-可同时检测成千上万个单细胞;
● 高准确性-通过大量重复测序降低误差;
● 高效性-可以帮助研究人员更快速地完成数据分析和结果解读。
此外,拥有专业生信分析团队帮助您更加深入地研究,差异基因分析、信号通路分析和聚类分析,为您提供完整的数据报告解读。如果您有相关需求,请与我们联系,我们将全程提供专业服务,满足您的科研需要。
参考文献
Liang Y,Kaneko K,Xin B,Lee J,Sun X,Zhang K,Feng GS.Temporal analyses of postnatal liver development and maturation by single-cell transcriptomics.Dev Cell.2022 Feb 7;57(3):398-414.e5.doi:10.1016/j.devcel.2022.01.004.PMID:35134346;PMCID:PMC8842999.
会议预告|CTI华测艾研邀您参加第二届单细胞技术及组学应用发展大会
为促进单细胞及组学应用领域的交流与发展,2023年5月19-20日第二届单细胞技术及组学应用发展大会,以“聚焦技术前沿,加速科研转化”为主题,特邀70+行业领袖,1000+专家代表;多形式打造全方位产学研资交流平台,邀请单细胞及组学领域的科学家、企业家、投资人等各界代表共商行业发展。
2023-05-15 10:30:55
质量为先|华测艾普再次满分通过全国实体瘤体细胞突变高通量测序室间质评!
近日,国家卫生健康委临床检验中心(NCCL)公布了2022年全国实体肿瘤体细胞突变高通量测序室间质量评价统计结果。华测艾普医学实验室再次满分通过此次NGS室间质评,持续体现着华测艾普医学在NGS检测方面扎实的实验能力、强大的生物信息分析能力以及可靠的质量管理体系运营!
2022-11-22 10:09:54
免疫力|带你了解可以防御“外敌“的免疫基因
免疫力是人体自身的防御机制,可以识别和消灭外来侵入的任何异物(病毒、细菌等),是处理衰老、损伤、死亡、变性的自身细胞和病毒感染细胞的能力。在人体受到外来物刺激之后,免疫系统会被激活,各种免疫相关调控因子介入,使得人体尽快恢复内环境稳定。
2022-05-09 07:53:05
- 热线电话
- 业务咨询
- 快速询价
- 在线客服
- 报告验证