文献解读 | 深度剖析 - 代谢流核心之MFA
在代谢研究中,基于稳定同位素辅助的代谢流分析(MFA)可以定量分析代谢动态过程,揭示代谢通路变化,了解代谢反应速率,真实反映代谢活动状态。iMFA的基本原理包括构建代谢网络模型、输入实验数据,拟合数据以获得代谢流图,是代谢研究领域的有力工具。
01代谢流分析概念
代谢流(Metabolic Flux)是指在特定代谢途径中,各个化学反应所转化的底物或产物的速率,通常以单位时间内的摩尔数或重量单位来表示。
代谢流分析(Metabolic Flux Analysis,MFA)是一种定量分析方法,用于研究细胞内代谢反应的动态过程。它通过同位素标记的底物,结合质量平衡和能量平衡的原则,推导出代谢网络中各反应的通量分布。
MFA可以通过测量底物的消耗速率或产物的生成速率,结合代谢途径中各反应的计量关系,研究人员能够确定未知的反应速率,从而绘制出代谢网络的通量分配图。
这种分析不仅能够精确描述代谢特性,还可以提供关于细胞生理状态的深入信息,帮助评估遗传和环境扰动的影响,并准确描述特定途径和反应的重要性。
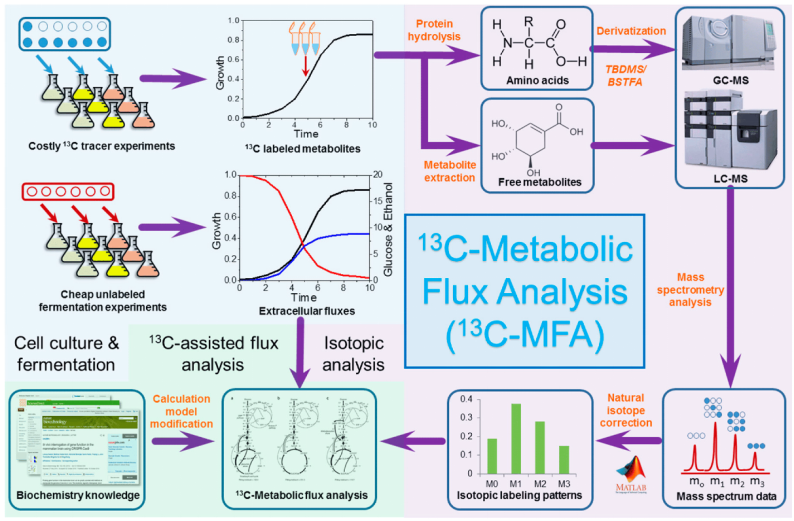
图1.显示基于13C标记的MFA原理及步骤
首先使用13C标记的底物作为碳源(比如[U-13C]葡萄糖)进行代谢物整体的标记,达到采样所需的稳态,即代谢和同位素稳态,此时细胞内代谢物浓度和同位素标记均恒定。
接下来样本可用于进一步的分析,使用GC-MS或LC-MS进行质谱鉴定,由于天然同位素的存在,可以选择几种成熟算法来系统校正,以计算目标代谢物的同位素分布,比如质量分布向量(MDV)。
基于各代谢物的MDV,可以定性和定量分析代谢行为,追踪关键代谢物中的13C标记模式(即MDVs)以及在代谢通路中的变化,来分析某代谢通路是否活跃,通过MDVs测量代谢通量,来量化多个代谢途径中的碳通量。
02 MDV概念
研究表明丹参酮IIA对肺纤维化具有显著的改善作用,减轻了TGF-β1诱导的成纤维细胞增殖,降低胶原蛋白I和III以及α-SMA蛋白的表达。
在MFA中的质量分布向量(Mass Distribution Vector,MDV)用于描述代谢物中同位素标记状态的相对丰度,通过测量代谢物的同位素标记模式可以推断细胞内代谢通量。比如说丙酮酸(Pyruvate)分子式为C3H4O2,含有3个碳原子,按照它被13C标记的数量和顺序,可以有8种不同标记状态,完全没被13C标记称为M+0,完全被13C标记则称为M+3,被标记一个或两个称为M+1或M+2,其中M+1或M+2按照被标记的位置又各有3种不同情况,因此有1+1+2*3+2*3=8种不同标记状态(可见图2)。
因此MDV是一个向量,以丙酮酸为例,从M+0到M+3标记状态的质量各不相同,通过测量这些不同质量代谢物的相对丰度,即可构建该代谢物的MDV,从而为每个代谢物提供一个独特的指纹,反映细胞内代谢流的情况。
当然由于自然界中存在一定比例的天然同位素,因此实验测量的MDV需要通过算法校正,以消除天然同位素的影响。
MDV是进行代谢流分析的关键输入数据之一,通过合适的数学模型或计算方法,利用MDV可以来推断和量化细胞内代谢网络中的代谢流,尤其适用于那些直接测量较为困难的代谢通路途径,为理解细胞代谢提供了一个强大的工具。
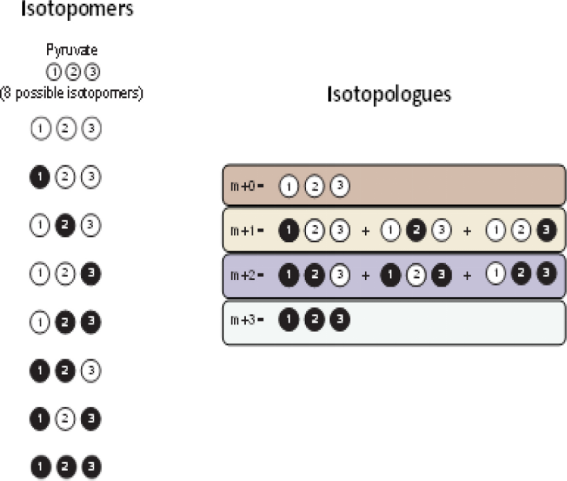
图2.以丙酮酸为例显示13C同位素不同的标记状态
按照标记数量和位置的不同可以分为8类同位素异构体(Isotopomers),而同位素标记体(Isotopologues)按照分子质量划分,可分为M+0、M+1、M+2和M+3标记体。
通过测量这些不同标记状态的丙酮酸分子的相对丰度,进行标准化和校正后,可以得到丙酮酸的MDV,从而进一步分析其在代谢网络中的动态变化和通量分布。
03 MFA应用的简化案例分析
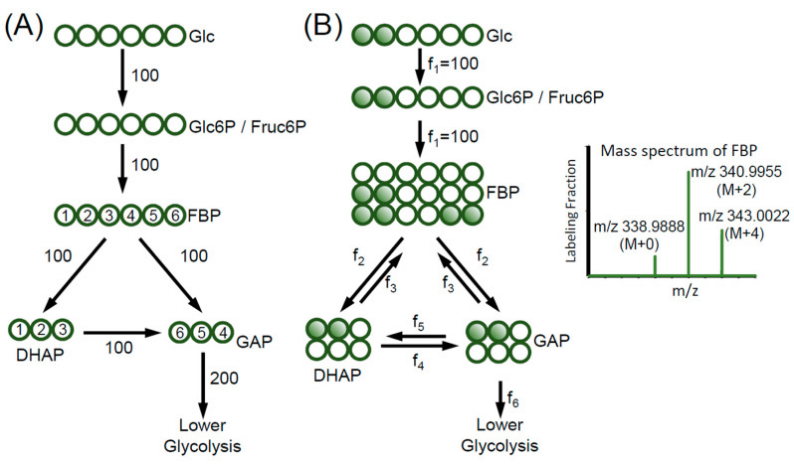
图3.以糖酵解为例来阐述如何使用MFA来揭示代谢网络中的复杂动态
(A)显示在没有同位素标记的实验,所获取代谢物转换信息有限,比如说,可以知道葡萄糖以100纳摩尔/小时的速率被消耗,而甘油醛-3-磷酸(GAP)以200纳摩尔/小时的速率进入下层糖酵解,除此外无法提供更多关于代谢通量的信息。(B)显示以[1,2-13C2]葡萄糖标记后,可以获取糖酵解反应可逆性信息:标记后果糖1,6-二磷酸(FBP)有三种状态:M+0、M+2和M+4,在质谱中可观测FBP的MDV信息,其中M+2的比例较高,而M+0的比例较低,从而可以洞察到代谢通路中的可逆,比如醛缩酶和三糖磷酸异构酶的逆向代谢(f3和f5)。
04 MFA应用的复杂代谢网络分析
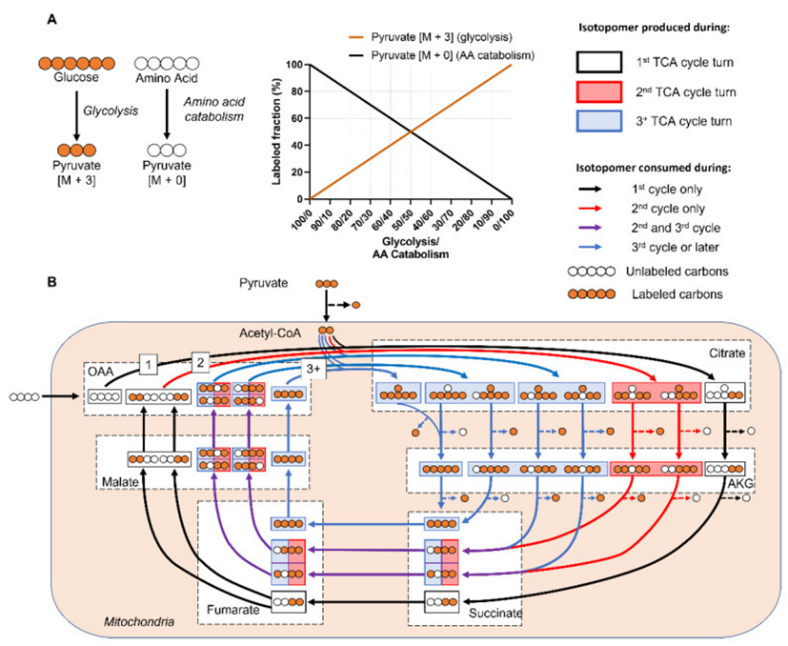
图4.显示哺乳动物代谢网络及相应标记状态
(A)假设丙酮酸来源于标记的葡萄糖或未标记的氨基酸,则丙酮酸的[M+3]/[M+0]比例取决于糖酵解与氨基酸分解的相对活性,随着糖酵解活性的增加,更多的丙酮酸会被标记。(B)在三羧酸(TCA)循环中,每一圈循环都会产生同位素标记代谢物,假设一个标记的葡萄糖和一个未标记的四碳分子作为碳源,随着TCA循环的圈数变化(不同颜色),OAA与已标记乙酰辅酶A一起形成[M+2]柠檬酸(黑色箭头),而第二轮TCA循环后,部分标记的延胡索酸产生的苹果酸增加,标记的柠檬酸增加(蓝色箭头),在实际中,TCA循环中存在多个补充途径和可逆反应,这些都增加了代谢网络的复杂性。缩写:柠檬酸(Cit)、α-酮戊二酸(AKG)、草酰乙酸(OAA)、果糖-6-磷酸(F6P)、葡萄糖-6-磷酸(G6P)、氨基酸(AA)。
05同位素辅助代谢通量分析(iMFA)基本原理
在实际研究中,代谢网络相当复杂,人工解析MDV非常具有挑战性,当前同位素辅助代谢通量分析(iMFA)是主要策略。
iMFA结合了代谢数据、同位素标记数据、代谢网络模型及计算方法,间接定量那些无法直接测量的细胞内代谢通量。iMFA通过利用通量值与质量分布向量(MDV)标记模式之间的关系,在代谢稳态条件下进行量化。
稳态下每个代谢物的MDV取决于其前体底物的MDV,并且每个前体的贡献都由其反应通量的大小加权,因此可以通过数学公式将MDVs与通量之间的关系表达为一组质量平衡方程,这个过程涉及到参数估计问题,通常通过优化方法来解决,优化过程从对系统中所有代谢通量的一个初始猜测开始,然后使用这些通量来生成模型中每个代谢物的初始模拟MDV,然后这些计算出的MDV与实验测量的MDV进行比较,并通过迭代过程优化估计的通量,以最小化模拟和实验MDV之间的差异,最终实验数据与模拟数据之间的误差被最小化到一个统计上可接受的程度,这一过程与当前流行的机器学习或深度学习有契合之处。
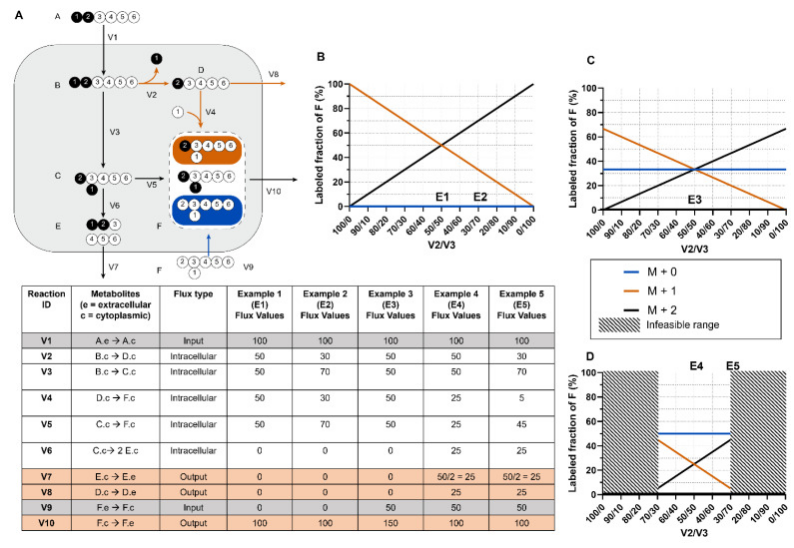
图5.同位素辅助代谢通量分析(iMFA)的基本原理:稳态下某代谢物的MDV等于其前体底物的MDV加权平均值
(A)描述了一个代谢系统,具有两个输入通量V1和V9、三个输出通量V7、V8和V10,五个不可逆反应V2、V3、V4和V5,相关细节在图A表中。(B)为理解基本原理,以代谢物F为例,F标记模式取决于代谢物C、D和外部来源F,其MDV值[M+1]和[M+2]完全依赖于V4和V5,而V4和V5依赖于V2和V3。因此F的[M+1]/[M+2]其实反应了代谢物B分别通过V2与V3代谢的百分比,由此将V1乘以基于MDV分析的V2/V3比值,可得出V2和V3的通量值。(C)仍以代谢物F为例,此次考虑到外源性未标记F被引入的情况,此时同位素标记的F代谢物池被稀释,[M+1]和[M+2]比例发生变化,此时的分析应考虑增加此变量。(D)仍以代谢物F为例,进一步考虑V7和V8的情况,这两个步骤的活跃,意味着同位素标记的C和D,在转化为F之前就被分泌出去,这也稀释了F同位素池,所以应进一步考虑增加此变量。
06同位素辅助代谢通量分析(iMFA)工作流程
iMFA需要三种输入信息:实验外部通量、代谢物MDV和代谢通路。实验外部通量指细胞或生物体与外界发生的代谢物交换速率,包括物质的摄取和分泌,比如摄取葡萄糖、谷氨酰胺,分泌乳酸、谷氨酸。
这些数据可以通过GC/LC-MS等获得代谢物浓度,然后基于代谢物浓度的变化转换为外部通量。
代谢物MDV的获取基于同位素标记示踪剂,比如[U-13C]葡萄糖适合于三羧酸(TCA)循环通路中代谢物,标记后谷氨酰胺研究α-酮戊二酸还原羧化和糖异生通路,氘(2H)用于线粒体和细胞质NADPH代谢。
在标记一段时间后,细胞或组织提取代谢物通过质谱(MS)分析,可获得每个感兴趣的代谢物及其相应的MDV数据。
代谢通路信息可以从相关文献或代谢数据库获取,比如KEGG、MetaCyc,有关通路的复杂性各不相同,对于哺乳类细胞来说可能主要关注糖酵解、TCA循环,更多通路的研究需求或信息获取可能需要投入精力进行相关文献的调研。
对于通路中的反应,或涉及几个不同类型需要注意:源反应(Source reactions)指那些在代谢网络中消耗但不由其他反应生成的代谢物的反应,例如从细胞外间隙摄取的葡萄糖或由细胞内脂肪酸氧化产生的乙酰辅酶A;汇反应(Sink reactions)指那些由其他反应产生但不被其他反应消耗的代谢物,用来表示代谢物的外排(如乳酸分泌)或细胞内储存(如预定用于糖原合成的葡萄糖或导向脂肪酸合成的乙酰辅酶A);内部反应(Internal reactions)指那些既被消耗又被其他网络反应产生的代谢物,通常是将源反应和汇反应联系起来,例如从葡萄糖衍生乳酸的糖酵解反应。这些反应需具有反应发生的定位信息,例如细胞质或线粒体。
在指定某种类型的生化反应之后,需要为每个反应指定“原子转移”(atom transitions),指在生化反应过程中,同位素标记的原子从底物到生成物,在反应前后的代谢物之间发生了转移和重排,基本上来讲,这种同位素原子的转移,是进行iMFA分析的核心,对于追踪代谢路径和理解代谢网络的动态变化至关重要。
当前有关原子转移的公式,可以从有关文献及KEGG、MetaCyc等数据库中获得,但在完整性和准确性方面仍有待发展。
在获取到有关外部通量、MDV和代谢图后,可应用一些代谢流分析软件进行计算,目前一些软件如eiFlux、INCA、METRAN、OpenMebius和13C2FLUX,都支持模型构建、通量估计和置信区间确定。
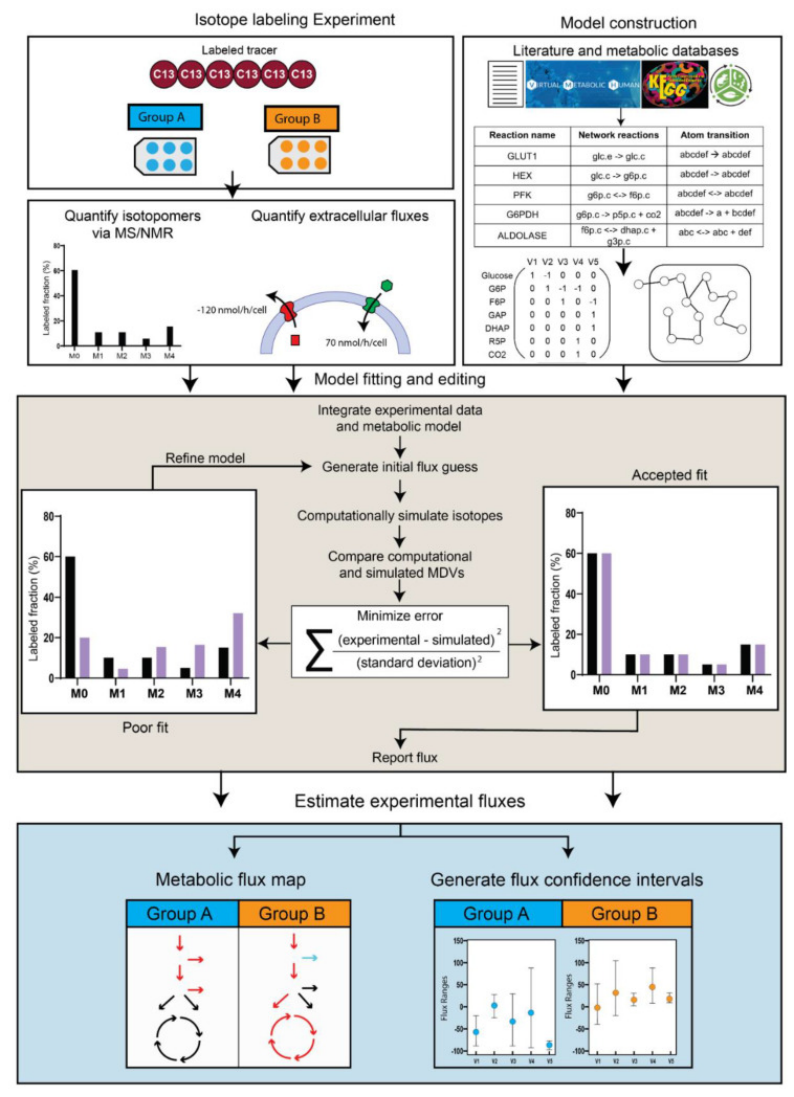
图6.显示iMFA的流程
实验部分主要为同位素标记(左上角),由实验获取MDV值和代谢通量值;代谢模型构建基于文献和数据库(右上角),具有生物类型、组织或细胞代谢反应类型和原子转换类型等参数,在iMFA软件中可作为表格输入;
模型拟合与编辑(中),将实验数据整合到代谢模型中,生成初始通量猜测,并计算模拟同位素分布,将其与实验测量值进行比较,继而迭代,通过最小化误差来优化模型参数,以获得最佳拟合结果;估计实验通量(下),根据优化后的模型计算出各代谢路径的实际通量,绘制代谢流地图并生成通量置信区间,可对不同条件下(如Group A vs Group B)的代谢通量差异进行对比分析。
此类软件的优点在于,可以通过迭代过程不断优化通量值,直到达到满意的拟合效果。
07可供参考的MFA有关程序
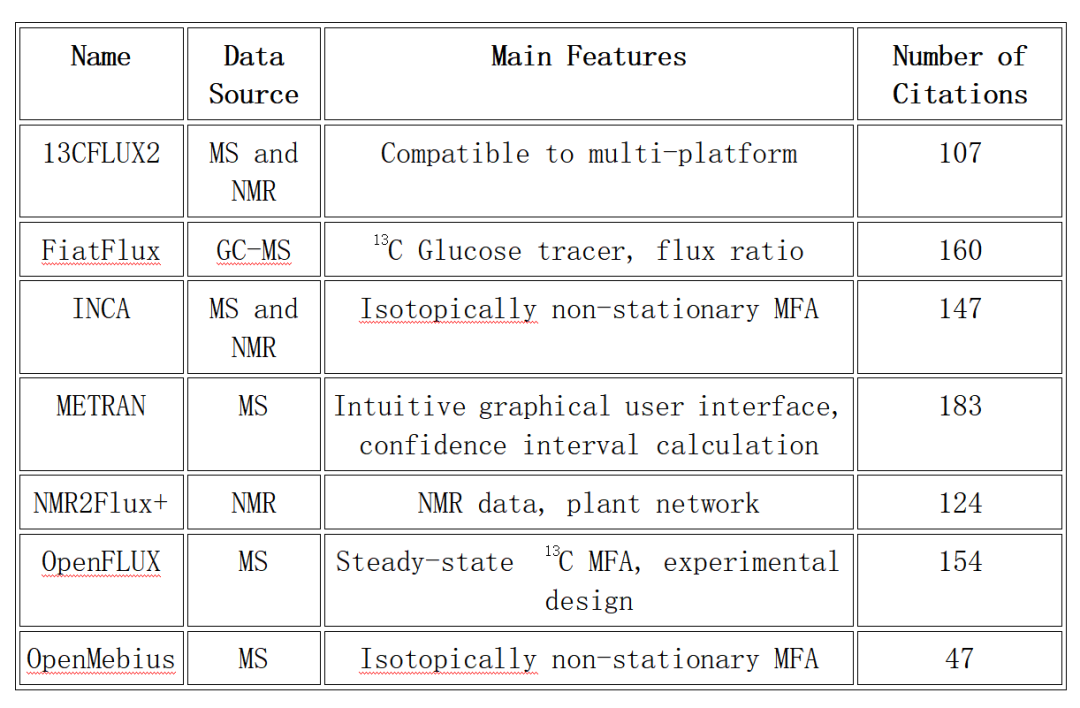
表1.显示一些已有代谢流分析程序,并提供了仪器类型、优势和引用信息
目前eiFlux、INCA、METRAN、OpenMebius和13C2FLUX等软件均支持模型构建、通量估计和置信区间确定。一些可视化工具,如Escher-Trace、FluxVisualizer等,均有助于实现通量图可视化。
08 iMFA在实验中的注意事项
1.示踪剂选择:在iMFA中,选择标记示踪剂、确定其相对丰度和混合方式是关键,这些因素共同影响代谢物的MDV标记模式。2.标记模式影响:示踪剂的标记原子位置决定了代谢途径的复杂性,如[1,2-13C]葡萄糖能区分糖酵解和PPP途径,而均匀标记的葡萄糖则不能。3.丰度和混合比例:示踪剂的丰度影响标记模式,适当的混合比例可以最大化信息量,但混合未标记的示踪剂会降低含有13C和12C原子的分子中示踪剂的有效性。4.优化示踪剂选择:为减少实验成本和时间,已开发了计算和算法方法来优化示踪剂选择和丰度。5.体内模型假设:体内模型需要假设标记同位素在组织中达到平衡,并且对体内通量的影响可以忽略不计,但这些假设需要在每个案例中进行测试。6.代谢稳态和同位素稳态:在进行iMFA时,需要考虑代谢稳态和同位素稳态,这影响代谢参数和代谢物标记的稳定性。7.淬灭过程:终止细胞代谢活动以提取代谢物的过程,需要防止代谢物降解和污染。8.测量MDVs的技术:LC-MS、GC-MS和NMR是测量MDVs的三种主要技术,每种技术都有其优势和限制。9.同位素自然丰度校正:在定量测量MDVs时,必须进行同位素自然丰度校正,以避免错误结论。10.细胞器分隔:在iMFA模型中指定代谢物和代谢反应所在的细胞器,对于模拟和实验MDVs之间的良好拟合至关重要。11.稀释反应:iMFA模型中包括稀释反应,需考虑未标记底物的影响,这可能导致代谢物标记分数降低。
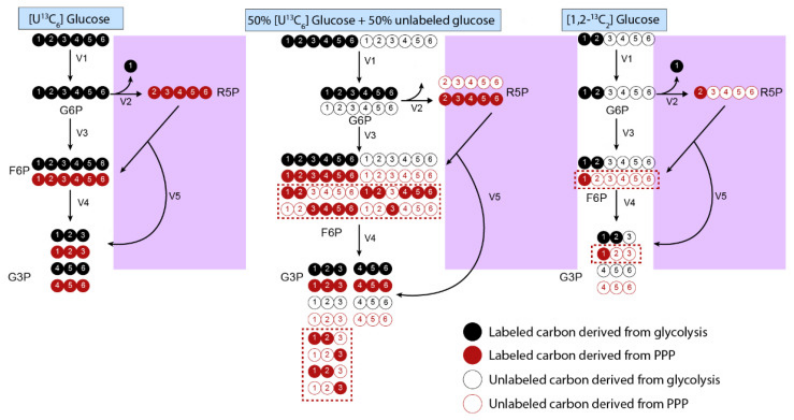
图7.显示在进行同位素辅助代谢通量分析(iMFA)时需注意示踪剂选择
如图中糖酵解途径所示,使用[U-13C6]葡萄糖同时影响磷酸戊糖途径(PPP,紫框)和糖酵解;
使用50%[U-13C6]葡萄糖和50%未标记葡萄糖组合,可更好观测PPP通路,因PPP中原子重排会导致M+1、M+2、M+4和M+5同位素体(红框),这些同位素体的百分比可用来分析PPP分支点通量;
选择使用[1,2-13C2]葡萄糖,则它在进入PPP后代谢成R5P产生M+1同位素体,进一步代谢成M+1 F6P和G3P,而直接代谢成F6P的葡萄糖会产生M+2同位素体,故通过比较代谢物如F6P和G3P中的M+1和M+2同位素体的比,以及乳酸和丙酮酸等衍生物的比,来确定PPP分支的相对活性。
缩写:葡萄糖-6-磷酸(G6P)、核糖-5-磷酸(R5P)、果糖-6-磷酸(F6P)、甘油醛-3-磷酸(G3P)、戊糖磷酸途径(PPP)。
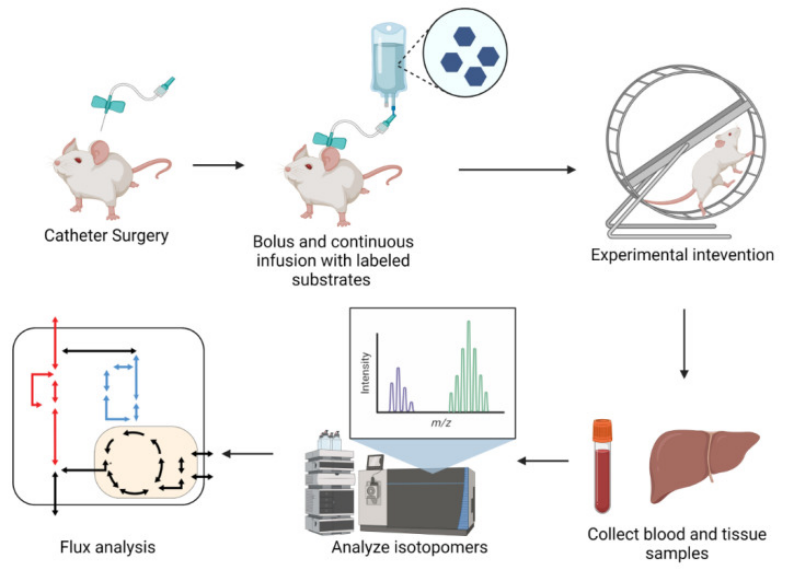
图8.显示一个体内iMFA实验流程
通过插管等方式给予小鼠冲击剂量的稳定同位素底物,进行实验处理,到代谢物达同位素稳态,然后收集血液和组织样本,用于核磁共振(NMR)或质谱(MS)分析,数据通过iMFA软件回归分析,以定量代谢流。
09挑战与展望
1.动态MFA(DMFA):这是一种非稳态方法,用于分析非稳态系统中的代谢变化,尤其是在细胞分化、激活和增殖等过程中。DMFA通过将实验分成时间间隔并进行iMFA来创建通量变化的时间轮廓,但面临实验和计算挑战。
2.基因组规模MFA:这种方法使用基因组规模模型来提供全面的系统视角,包括所有代谢物和反应。它要求额外的实验数据来解决外围通量,并可能需要使用简约13C MFA来最小化所有反应通量的总和,以提高模型的准确性。
3.共培养和交叉对话:在共培养研究中,iMFA可以分析不同细胞类型间的代谢通信,而无需物理分离细胞。这种方法将细胞建模为不同的隔室,并使用“f1”参数来代表物种1的群体比例,为研究细胞间代谢相互作用和运输提供了新的可能性。
iMFA通过分析复杂的代谢数据生成通量图,帮助识别细胞状态间的代谢差异、关键代谢节点和酶靶点。它还能提出新假设,补充其他组学技术。尤其在解析TCA循环和线粒体代谢方面,iMFA显示出其独特优势。
随着模型和方法的进一步发展,iMFA预计将在癌症、干细胞分化、遗传性代谢疾病和代谢相关疾病等领域提供更多洞见,并将成为生物医学研究者的工具,揭示疾病中的新代谢机制。
参考文献
Guo W,Sheng J,Feng X.13C-Metabolic Flux Analysis:An Accurate Approach to Demystify Microbial Metabolism for Biochemical Production.Bioengineering.2016;3(1):3.https://doi.org/10.3390/bioengineering3010003Moiz B,Li A,Padmanabhan S,Sriram G,Clyne AM.Isotope-Assisted Metabolic Flux Analysis:A Powerful Technique to Gain New Insights into the Human Metabolome in Health and Disease.Metabolites.2022 Nov 4;12(11):1066.doi:10.3390/metabo12111066.Wang Y,Wondisford FE,Song C,Zhang T,Su X.Metabolic Flux Analysis-Linking Isotope Labeling and Metabolic Fluxes.Metabolites.2020 Nov 6;10(11):447.doi:10.3390/metabo10110447.Moiz B,Sriram G,Clyne AM.Interpreting metabolic complexity via isotope-assisted metabolic flux analysis.Trends Biochem Sci.2023 Jun;48(6):553-567.doi:10.1016/j.tibs.2023.02.001.Epub 2023 Mar 1.
华测多组学科研服务AI+靶向代谢组学智能临床转化平台亮相第二届多组学科研大会
2024年3月30日至31日,第二届多组学科研与临床应用大会在上海丽昂豪生大酒店盛大开幕,大会以“聚焦多组学,从科研到临床”为主题,吸引了国内外众多专家学者相关的基础研究、临床应用、产业从业者参与,全场座无虚席。
2024-04-02 00:59:15
柿子变身记:这个冬天,“柿柿”如意
CTI华测检测可为您提供柿子等新鲜果蔬的营养品质、农药残留、产地环境等检测套餐服务。我们拥有专业的技术支持团队与一流的检测团队,为食品安全保驾护航。
2021-12-22 09:02:36
CTI华测检测开通深圳地区数字证书业务
随着2021深圳全球招商大会举行,当前深圳进入了“双区”驱动、“双区”叠加的黄金发展期,国际一流营商环境催生了377万户商事主体。近日,华测CA顺应市场所需助力网上商事登记,在深圳已推出个人数字证书业务,ODC组织机构数字证书业务也即将上线。
2021-12-20 06:06:12
- 热线电话
- 业务咨询
- 快速询价
- 在线客服
- 报告验证





