什么是TP53基因 TP53的重要功能有哪些
什么是TP53基因
TP53基因位于17号染色体的短臂上(17p13.1),编码一种含有393个氨基酸残基的蛋白p53,在细胞中扮演着重要的角色。包含一个n端反活化结构域(TAD,残基1-61),一个富含脯氨酸的结构域(PRD,残基64-92),一个与四聚化结构域(TET,残基324-356)连接的dna结合结构域(DBD,残基96-292)和一个c端调控结构域(CTD,残基364-393)。p53蛋白是一种能够激活多种靶基因表达的转录因子,在调节细胞周期、细胞凋亡、基因组稳定性等方面发挥着关键作用,被广泛认为是“基因组的守护者”。越来越多的证据表明,p53还调节细胞代谢、铁下垂、肿瘤微环境、自噬等,这些都有助于抑制肿瘤。TP53的突变不仅损害其抑瘤功能,而且还赋予p53突变体致癌特性。
TP53的重要功能
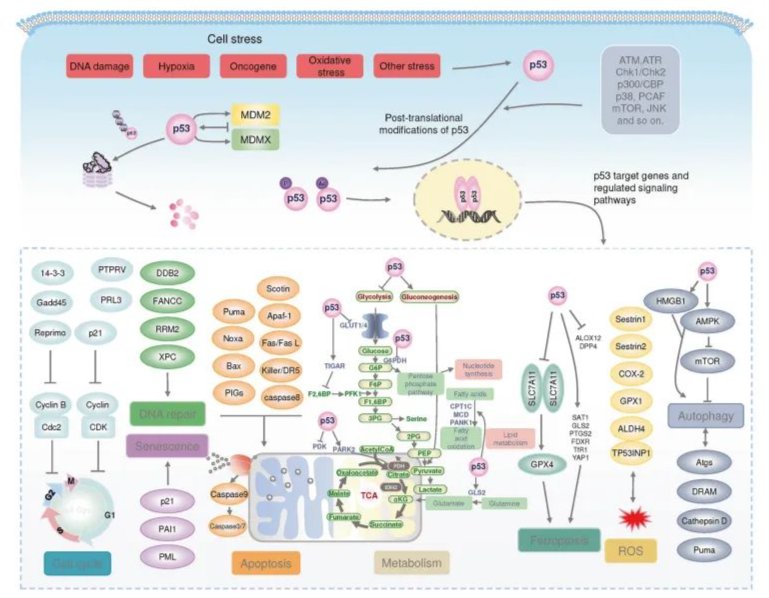

基因组稳定性
p53被认为是基因组的守护者。它在维持基因组稳定性方面起着重要作用。当DNA受损时,p53通过协调多种DNA损伤修复机制来保护基因组p53蛋白激活DNA修复蛋白DDB2和XPC的表达。这些蛋白与效应蛋白的相互作用可能导致各种细胞命运,如凋亡、衰老或肿瘤发生。
衰老
衰老是一种永久性的细胞周期停滞。P53介导的衰老与其抑瘤作用密切相关。DNA损伤会引发衰老,这一过程通常被称为压力诱发的过早衰老。各种内部或外部应激源触发DNA损伤反应途径,激活p53和/或p16INK4A途径。p16INK4A使Cdk4/6失活,使Rb积累磷酸化,使E2F转录失活,导致细胞周期阻滞或衰老。另外,当紫外线诱导的DNA损伤发生时,ATM/ATR激活Chk1/Chk2激酶,进而激活p53和p21CIP1,导致G1阻滞或衰老。此外,p53通过稳定纤维蛋白原激活物抑制剂-1(衰老细胞的标志)直接诱导衰老。
代谢平衡
肿瘤细胞需要大量的生物原料和能量来实现其快速和持续的生长。最初提出的Warburg效应指出,肿瘤细胞代谢葡萄糖的方式与正常细胞不同,这可以通过糖酵解增强和乳酸生成增加来证明。p53对糖酵解途径的调控有助于维持细胞代谢的稳态,从而起到肿瘤抑制的作用。p53可以转录氧化磷酸化所需的靶基因,如SCO2;或者抑制糖酵解的基因,如TIGAR和parkinson。p53与戊糖磷酸途径的限速酶G6PDH结合,进一步抑制肿瘤细胞中活化的戊糖磷酸途径。p53通过抑制葡萄糖转运蛋白如GLUT1和glut4的表达和易位来抑制葡萄糖摄取和糖酵解。糖酵解和糖异生在一定程度上是可逆的过程。P53抑制糖酵解促进糖异生过程。由于肿瘤细胞高度依赖糖酵解和Warburg效应进行增殖和侵袭,p53对糖酵解的抑制往往会阻碍癌细胞的生长。
铁下垂
铁下垂是一种受调节的细胞死亡形式,主要由严重的脂质过氧化引起。据报道,p53通过转录抑制SLC7A11的表达来抑制胱氨酸摄取并促进铁凋亡,SLC7A11是胱氨酸-谷氨酸反转运蛋白的关键成分。p53的表达通过增加gsh的生物合成进一步增强了GPX4拮抗铁下垂的能力。p53还以非转录方式调节SLC7A11的表达。p53(3KR)是一种乙酰化缺陷突变体,不能诱导细胞周期阻滞、细胞凋亡和衰老,但保留了调节SLC7A11表达的能力。另一个p53突变体(4KR)失去了调节SLC7A11表达的能力。
肿瘤微环境
p53在肿瘤细胞中的状态对免疫微环境有着深远的影响。p53调节细胞因子的释放,刺激巨噬细胞向M1表型极化,抑制肿瘤发生。缺乏p53的巨噬细胞向M2极化并增强癌前细胞的增殖。p53激活刺激细胞抗肿瘤反应,导致干扰素的产生,并且在癌症免疫治疗之间存在协同作用,癌症中p53的缺失或突变会影响T细胞的募集和活性,导致癌细胞的免疫逃避。恢复p53表达可增强抗pd -1单克隆抗体对肝癌细胞的抗肿瘤作用,有效诱导肿瘤微环境重编程TP53突变与PD-L1表达增加相关,这可能是PD-L1靶向检查点抑制剂反应的预测因子突变的TP53有助于调节肿瘤细胞进入有利于生长的免疫微环境。
肿瘤干细胞自我更新
Rb/p53信号通路在损伤早期调控神经内分泌细胞的增殖和自我更新过程神经内分泌细胞在完成有限增殖后恢复到静止状态而在Rb/p53功能缺失的情况下,神经内分泌细胞可获得持续的增殖功能,发展为小细胞肺癌。p53在乳腺、前列腺、表皮、中枢神经系统和造血干细胞中的激活会阻碍干细胞的自我更新,但其确切机制仍有待证实。p53在调节正常和恶性干细胞分化和自我更新中发挥重要作用。相反,突变的p53有助于癌症干细胞的维持,突变型p53通过调节WASP互作蛋白增强癌症干细胞的增殖,突变型p53也通过上调FOXH1来增强造血细胞的自我更新能力。
自噬
自噬通过溶酶体途径降解细胞内大分子,从而实现细胞内能量供应和细胞器更新。p53可直接激活损伤调节的自噬调节因子并诱导自噬。自噬受自噬相关基因(Atg)控制。结合ChIP测序和RNA测序分析发现,p53与许多自噬基因结合,包括Atg2、Atg4、Atg7和Atg10。这表明p53以转录依赖的方式诱导自噬。组织蛋白酶D是一种溶酶体天冬氨酸蛋白酶,组织蛋白酶D的过度表达会激活自噬。p53结合到组织蛋白酶D启动子区域的两个DNA位点并调节组织蛋白酶D的表达。p53上调TGM2表达可增强自噬,从而抑制人乳腺原代上皮细胞的癌性转化和肿瘤形成。
其他细胞过程
参与p53调控的信号通路还包括免疫应答、非编码RNA等发挥抑瘤作用的信号通路。在肿瘤发生发展过程中,p53通过多方面调控抑制肿瘤转化、增殖、转移和耐药。P53具有异常灵活的生物反应,可随着细胞类型、细胞分化状态、应激条件和环境中不同信号的变化而改变。
TP53的突变频率

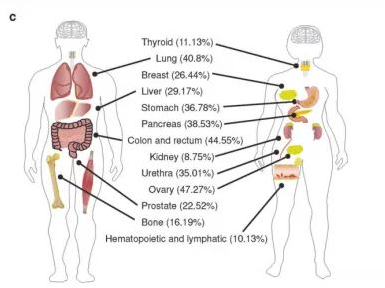
TP53突变常见于卵巢(47.27%)、结肠直肠(44.55%)、肺(40.8%)、胰腺(38.53%)、胃(36.78%)、尿道(35.01%)、肝脏(29.17%)、乳房(26.44%)、前列腺(22.52%)、骨骼(16.19%)、甲状腺(11.13%)、造血淋巴(10.13%)和肾脏(8.75%)(https:// cancer.sanger.ac.uk/cosmic)。TP53在食管癌(93.77%)、小细胞肺癌(79.06%)、卵巢癌(80.46%)、结直肠癌(74.45%)和胆囊癌(57.77%)中突变较多,在甲状腺癌(3.13%)、胚胎瘤(2.08%)和周围神经系统(1.25%)中突变较少。
TP53作为肿瘤抑制基因和基因组守护者,维持p53正常功能的细胞不太可能发生癌细胞转化。TP53突变为肿瘤的发生提供了有利的环境。TP53突变是一种被称为Li-Fraumeni的遗传性癌症易感性综合征的标志。肿瘤细胞中发现的高频率TP53突变可能是选择压力的结果,这种压力有利于肿瘤细胞逃避监视并免于死亡。
TP53抑癌基因检测套餐
预防大于治疗!P53抑癌基因检测套餐,了解男女性多项癌症(包括肺癌、食管癌、结直肠癌、前列腺癌、骨肉瘤、神经胶质瘤、头颈癌、乳腺癌、卵巢癌)遗传风险,以便提前干预,精准体检。TP53 是一个广谱性抑癌基因,基因变异增加多种癌症的遗传风险。
样本要求
1、血液:EDTA抗凝血(紫头管),2mL,1管,0°以下加暖宝宝寄送,35°以上加冰袋寄送。
2、拭子:口腔拭子,2管(左右腮帮子各一管,各刮30-50次),常温寄送。
检测周期
7个工作日。
适用人群
关注健康的人群等。
参考文献
Wang, H., Guo, M., Wei, H. et al. Targeting p53 pathways: mechanisms, structures, and advances in therapy. Sig Transduct Target Ther 8, 92 (2023). https://doi.org/10.1038/s41392-023-01347-1
CTI华测艾普满分通过2023年“全国血液微生物cfDNA宏基因组高通量测序室间质量评价预研活动”
11月15日,国家卫生健康委临床检验中心公布了2023年全国血液微生物cfDNA宏基因组高通量测序室间质量评价预研活动结果报告,经过严格的考核与评估,华测艾普医学检验所(以下简称“华测艾普“)满分通过了此次考评,以优秀的成绩展现了其精准化医疗服务的实力,代表着华测艾普的检测能力获得国家权威机构的充分认可,是华测艾普医学技术实力和高质量水平的充分体现,也印证了华测艾普在病原微生物宏基因组检测领域的重要地位。
2023-11-20 22:34:55
免疫力|带你了解可以防御“外敌“的免疫基因
免疫力是人体自身的防御机制,可以识别和消灭外来侵入的任何异物(病毒、细菌等),是处理衰老、损伤、死亡、变性的自身细胞和病毒感染细胞的能力。在人体受到外来物刺激之后,免疫系统会被激活,各种免疫相关调控因子介入,使得人体尽快恢复内环境稳定。
2022-05-09 07:53:05
不同加工工艺对产品中目标基因检测的影响因素探讨
近年来,随着分子生物学技术的不断更新迭代,以分子生物学技术为基础的掺假掺伪检测、特定基因成分检测、过敏原成分分析等技术方法被大量应用于产品安全检测领域,相关检测结果也被作为产品真伪、原料溯源等方面的重要参考依据,但受多重因素影响,在实际检测过程中经常遭遇DNA无法提取或者提取质量较差等情况,从而影响目标基因的定性检出或定量检测。
2022-01-14 01:33:36
- 热线电话
- 业务咨询
- 快速询价
- 在线客服
- 报告验证





