医疗软件注册登记检测
旨在指导制造商提交医疗器械软件注册申报资料,同时规范医疗器械软件的技术审评要求。
CTI华测检测为您提供医疗软件注册登记检测,拥有CMA、CNAS资质,可以为医疗器械独立软件或软件组件提供检测服务,配备专业的技术支持和检测团队,具备丰富的医疗软件注册检测项目经验。

服务背景
医疗器械软件包括独立软件和软件组件。
独立软件:作为医疗器械或其附件的软件;软件组件:作为医疗器械或其部件和附件组成的软件。
软件组件可兼具处理功能。专用型独立软件可单独注册,也可随医疗器械产品注册,此时视为软件组件。
医疗器械软件在注册申报前,检测是必不可少的一步。
服务内容
医疗器械软件检测需提交的资料有:产品技术要求、产品说明、用户文档集、测试文档集。

资料要求对应上述资料,其具体要求有:
产品技术要求
有专用模板,详见《医疗器械软件注册技术审查指导原则》中《附录I 独立软件产品技术要求模板》。
产品说明
在ISO/IEC 9127《软件工程 用于顾客软件包的用户文档集和封面信息》中,有关封面信息的段落可用作编制产品说明的输入。
根据GB/T 25000.51中5.1的内容编写产品说明,内容要求有:
A.阐明所运行软件的质量特性。
B.应包含潜在需方所需信息,以便评价该软件对其需要的适用性。
C.应避免产品说明内容之间的不一致。
D.特性陈述应是可测试的或可验证的。
用户文档集
在ISO/IEC 9127 《软件工程 用于顾客软件包的用户文档集和封面信息》中,有关封面信息的段落可用于创建用户文档集。
根据GB/T 25000.51中5.2的内容编写用户文档集,内容要求为:用户文档集包括的功能应是可测试的或可验证的。
测试文档集
测试文档集应根据GB/T 25000.51中6.3的要求编写。测试文档集内容要求如下:
A.测试文档集一般应包括:a.测试计划;b.测试说明;c.测试结果(报告)
B.测试文档集应包含组成该汇集的全部文档的清单,清单中应包含全部文档的标题及其表示符;
C.测试文档集中的每个文档都应包括:标题、产品标识、修改历史或说明该文档演变的任何其他元素、目次或对内容的说明、该文档正文中引用的文档的标识符、有关作者和审查者的信息、术语表。
D.测试文档集可由一个文档或多个文档组成。
测试标准
GB/T 25000.51-2016《系统与软件工程 系统与软件质量要求和评价(SQuaRE) 第51部分:就绪可用软件产品(RUSP)的质量要求和测试细则》
GB/T 25000.10-2016《系统与软件工程 系统与软件质量要求和评价(SQuaRE) 第 10 部分:系统与软件质量模型》
注意事项
A.软件版本和软件的命名规则,均需要按照软件注册指导原则中的规则来制定;
B.具有测量功能的软件,需测试其精度,需准备标准的参照物;
C.测试用例中,需对每个模块中的每个功能逐一测试,不可有疏漏,硬件测试不属于测试用例范畴;
D.软件需保存在介质中,介质上需注明软件名称、版本及公司信息,并需要递交给检测所;
E.硬件信息需详细写明并可实际提供,在检测时可能被要求携带设备前往。
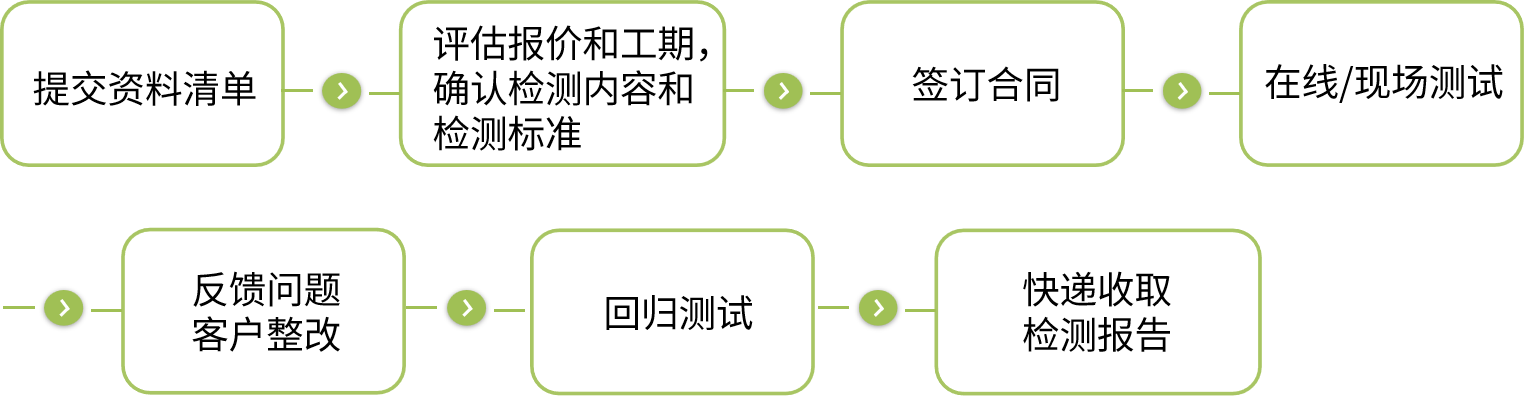
服务流程
- 热线电话
- 业务咨询
- 快速询价
- 在线客服
- 报告验证

 在线下单
在线下单

检测3.0.jpg)