ISO 13485医疗器械质量管理体系认证
ISO 13485医疗器械质量管理体系认证
ISO 13485标准是适用于医疗器械的质量管理体系标准,其全称是《医疗器械 质量管理体系 用于法规的要求》。ISO 13485标准采用了基于ISO 9001标准PDCA的相关理念。
服务背景
医疗器械是一种仪器、设备、器具、机器、植入物、体外试剂或其他类似产品,旨在用于疾病的诊断、预防和治疗。医疗器械种类繁多,从基本的手动工具到复杂的计算机控制机器。这些包括简单的设备,如伤口敷料和手术刀;轮椅和牙医椅等耐用设备;植入式设备,如心脏起搏器和监护仪、假肢和假关节;呼吸器和肺呼吸机等生命支持设备;复杂的软件控制设备如 CT 扫描仪和 MRI 机器;以及体外诊断试剂和检测试剂盒。
认证意义
✓ 证明符合法规和法律要求;
✓ 确保建立始终如一的质量管理体系及安全有效的医疗器械;
✓ 能有效管理其风险;
✓ 必要时改进流程和效率;
✓ 获得竞争优势。
ISO 13485医疗器械质量管理体系认证
法规要求
ISO 13485标准是适用于医疗器械的质量管理体系标准,其全称是《医疗器械 质量管理体系 用于法规的要求》。ISO 13485标准采用了基于ISO 9001标准PDCA的相关理念。相较于ISO 9001标准普适于所有类型的组织,ISO 13485主要针对与医疗器械设计开发、生产、贮存和流通、安装、服务和最终停用及处置等相关行业的组织。其采用ISO 9001的章节架构,在此基础上融合了FDA QRS820等世界各国体系法规要求及当前最新技术法规要求。
目前组织可以依据ISO 13485版标准建立体系或者自愿寻求第三方认证。
ISO13485标准重点内容
1.本标准以法规要求为主线,强化了企业满足法规要求的主体责任;
2.本标准强调基于风险的方法管理过程,强化组织应将基于风险的方法应用于控制质量管理体系所需的适当过程 (风险管理参考ISO 14971) ;
3.本标准重点强调与监管机构进行沟通和报告的要求;
4.本标准在ISO 9001的基础上,更加强调形成文件的要求和记录的要求。
ISO 13485适用于什么类型的企业组织
ISO 13485认证主要涉及的组织类型包括:医疗器械设计开发和生产商、经销商、服务提供组织、软硬件开发商以及零部件/材料供应商。
适用相关产品范围
ISO 13485认证涉及的相关产品分为7个技术领域:
1.非有源医疗设备;
2.有源(非植入)医疗器械;
3.有源(植入)医疗器械;
4.体外诊断医疗器械;
5.对医疗器械的灭菌方法;
6.包含/使用特定物质/技术的医疗器械;
7.医疗器械有关服务。
ISO 13485认证申请的条件
1.取得国家工商行政管理部门或有关机构注册登记的法人资格或其组成部分;
2.已取得相关法规规定的行政许可;
3.设计开发、生产、销售的产品或提供的服务符合国家相关法律、法规和有关规范的要求;
4.建立和实施了企业医疗器械质量管理体系,且有效运行3 个月以上;
5.在一年内,未发生违反国家相关法律法规的事故;
6.三年内未因违反相关法律法规而被其他认证机构撤销医疗器械质量管理体系认证证书;
7.未被执法部门责令停业整顿或在全国企业信用公示系统中被列入“严重违法企业名单”。
ISO 13485认证流程
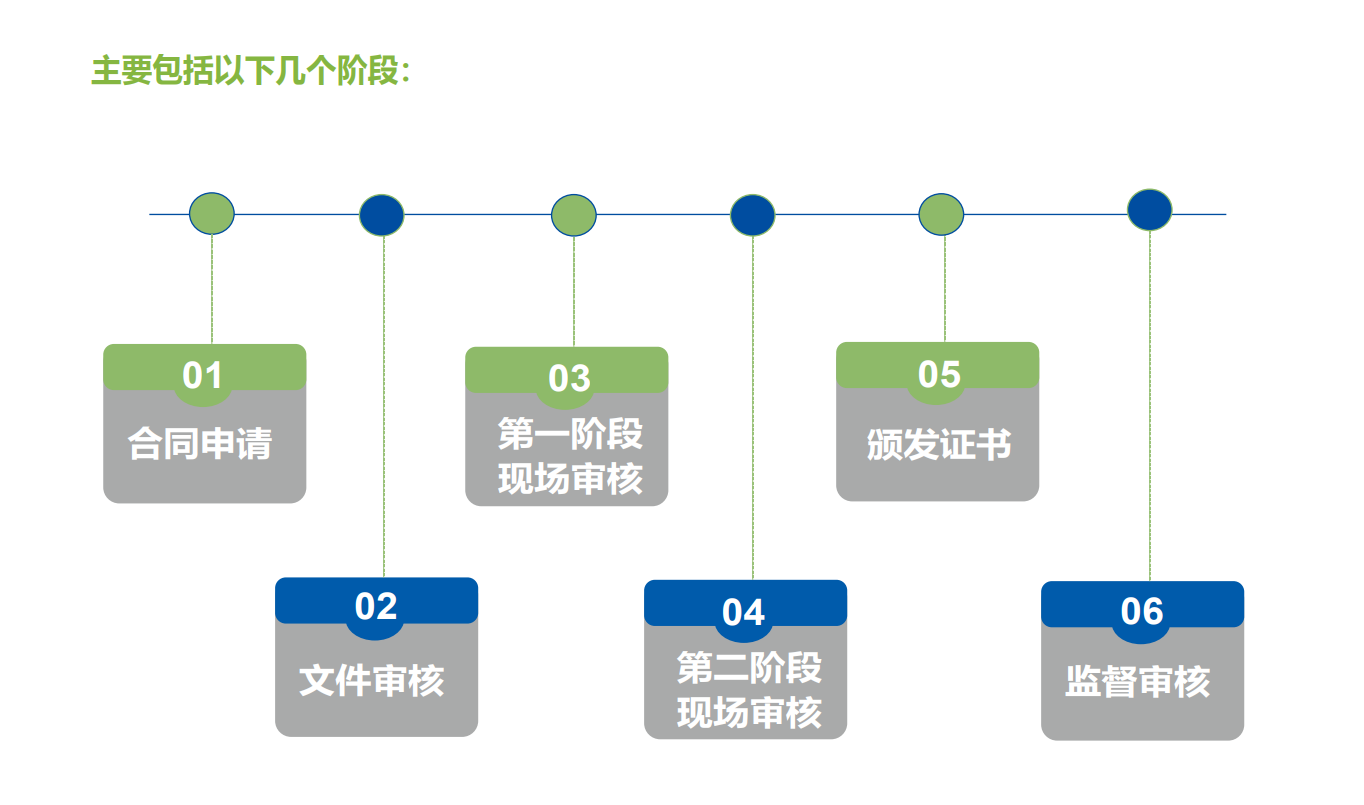
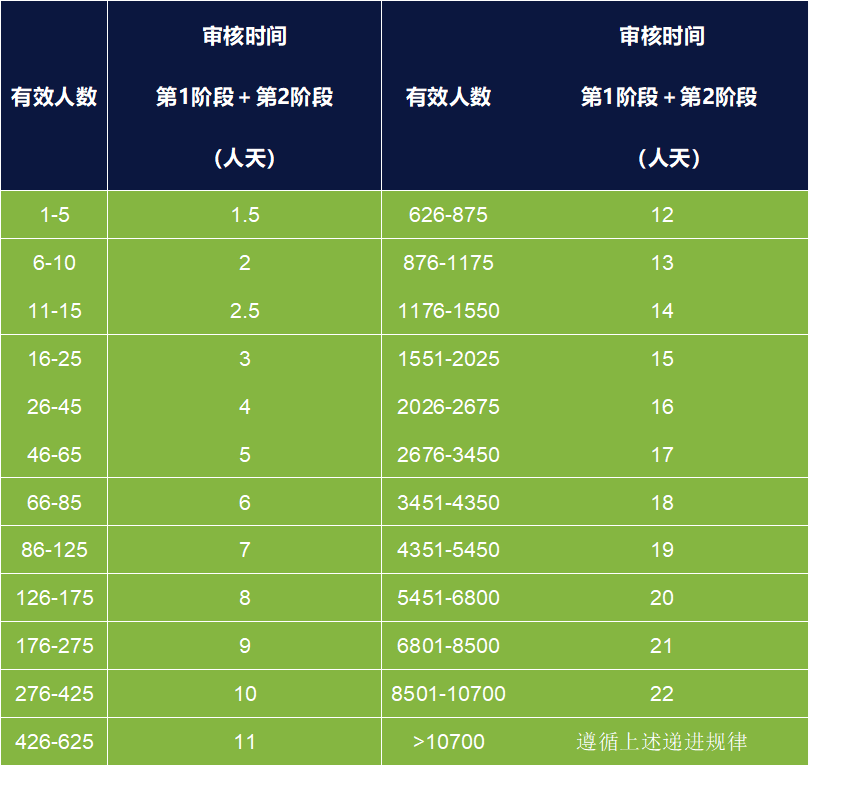
ISO 13485审核时间要求
服务优势
权威认可
CTI华测认证成立于2004年,改制于1993年成立的CQC深圳评审中心,是经中国国家认证认可监督管理委员会(CNCA)批准,经中国合格评定国家认可委员会(CNAS)认可,具有独立第三方公正地位的专业认证机构。
就近服务
CTI华测认证总部设在深圳,在北京、上海、杭州、广州、东莞、成都、厦门、长春、大连、武汉、兰州、苏州、长沙、合肥、西安、青岛、天津,太原、呼和浩特、重庆、昆明、贵阳、郑州、南宁、南昌、福州等地设立有分子公司和办事处。主要业务包括四大版块:认证服务、可持续发展服务、ESG和绿色金融评估服务以及培训服务。
- 热线电话
- 业务咨询
- 快速询价
- 在线客服
- 报告验证

 在线下单
在线下单






.jpg)

.jpg)

