文献解读 | 代谢流揭示温度如何影响棕色脂肪中糖酵解途径的变化
棕色脂肪组织(BAT)能够将化学能转化为热能,对于维持体温和代谢健康至关重要。尽管已知BAT大量消耗葡萄糖,但葡萄糖代谢如何支持产热的具体机制尚不明确。
本研究旨在通过结合转录组学、代谢组学和体内同位素追踪技术,系统分析小鼠BAT在急性和慢性寒冷暴露下的葡萄糖利用情况。
01研究方法
研究设计了环境温度适应实验(30°C、22°C和6°C)和短期寒冷应激实验(6°C突然暴露5小时),评估小鼠棕色脂肪组织在不同条件下的代谢反应。
使用稳定同位素标记的葡萄糖([U-13C]-glucose)作为示踪剂,通过口服方式给药后,收集血清和BAT样本,使用液相色谱-质谱联用技术(LC-MS)分析样本中的代谢物丰度和同位素标记,使用主成分分析(PCA)来区分不同温度条件下的BAT代谢组,通过代谢途径影响分析探索在寒冷适应过程中被激活的代谢途径。
研究结合BAT样本的RNA测序数据,分析不同温度下的基因表达差异,将代谢组学数据与转录组学数据相结合,详细分析葡萄糖在棕色脂肪组织中的代谢流,揭示在不同温度条件下BAT如何调整其代谢途径以适应环境变化。
02研究结果
研究结果揭示了,6°C环境下的小鼠具有明显不同的代谢物特征,比如循环AMP增加等,意味着与BAT的热生成功能密切相关。
分析发现糖酵解和TCA循环代谢物标记显著增加,表明这些代谢途径在寒冷适应中起着关键作用,同时PPP(戊糖磷酸途径)、脂肪酸合成、核苷酸合成和磷脂合成等辅助代谢途径在寒冷适应中被激活。
与对照组相比,急性寒冷暴露的小鼠BAT中的糖酵解中间体标记增加,表明糖酵解通量增加,同时增加的也有TCA循环中间体和谷氨酰胺/谷氨酸的标记物。
代谢流分析发现,葡萄糖在BAT中不仅用于糖酵解和TCA循环,还用于合成脂肪酸、酰基肉碱和其他代谢物,表明脂质的快速合成和氧化在寒冷适应中起着重要作用。
研究注意到基因表达与代谢流的不同,或许表明在寒冷适应过程中,转录后调控机制可能在葡萄糖利用中起着关键作用。
03研究结论
研究揭示了棕色脂肪组织(BAT)在不同温度条件下对葡萄糖代谢的高度适应性和多功能性,BAT能够根据环境温度的变化,调整其代谢途径,以满足能量需求和体温调节。
研究增进了对棕色脂肪组织在代谢调控中作用的理解,为开发新的治疗策略提供了潜在的靶点,可能有助于治疗肥胖、糖尿病和其他代谢相关疾病,强调了棕色脂肪组织在调节能量平衡和体温中的重要性,为未来的代谢研究和药物开发提供了新的视角。
04研究结果展开
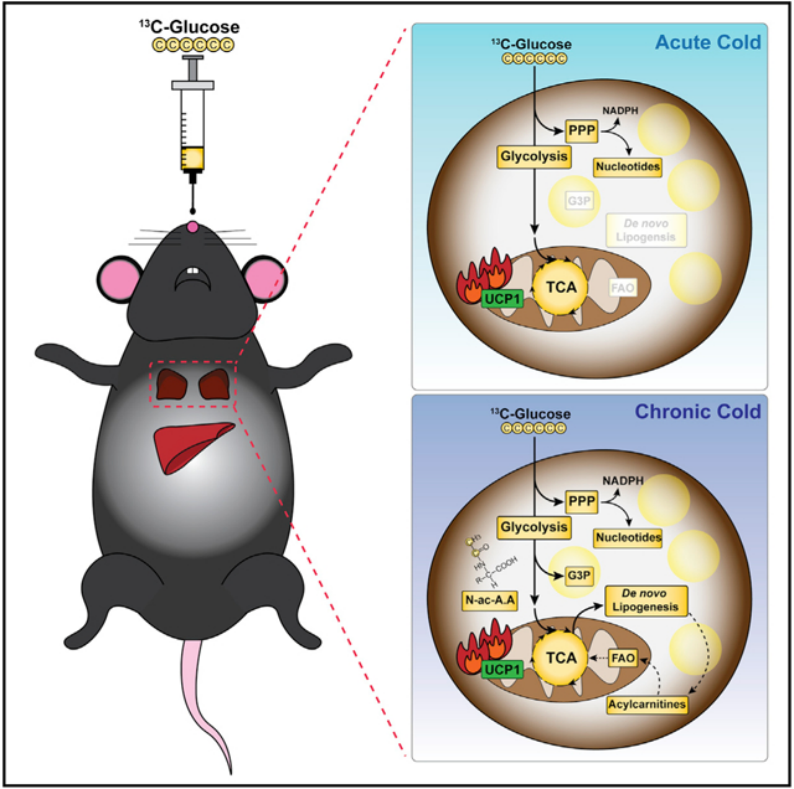
图1.概括了课题主要发现
以代谢流技术揭示了不同温度下棕色脂肪组织(BAT)的代谢通路变化。稳定同位素葡萄糖标记结合代谢组学检测,发现了寒冷应激与寒冷适应之间,葡萄糖碳原子在BAT代谢途径中存在分布差异。
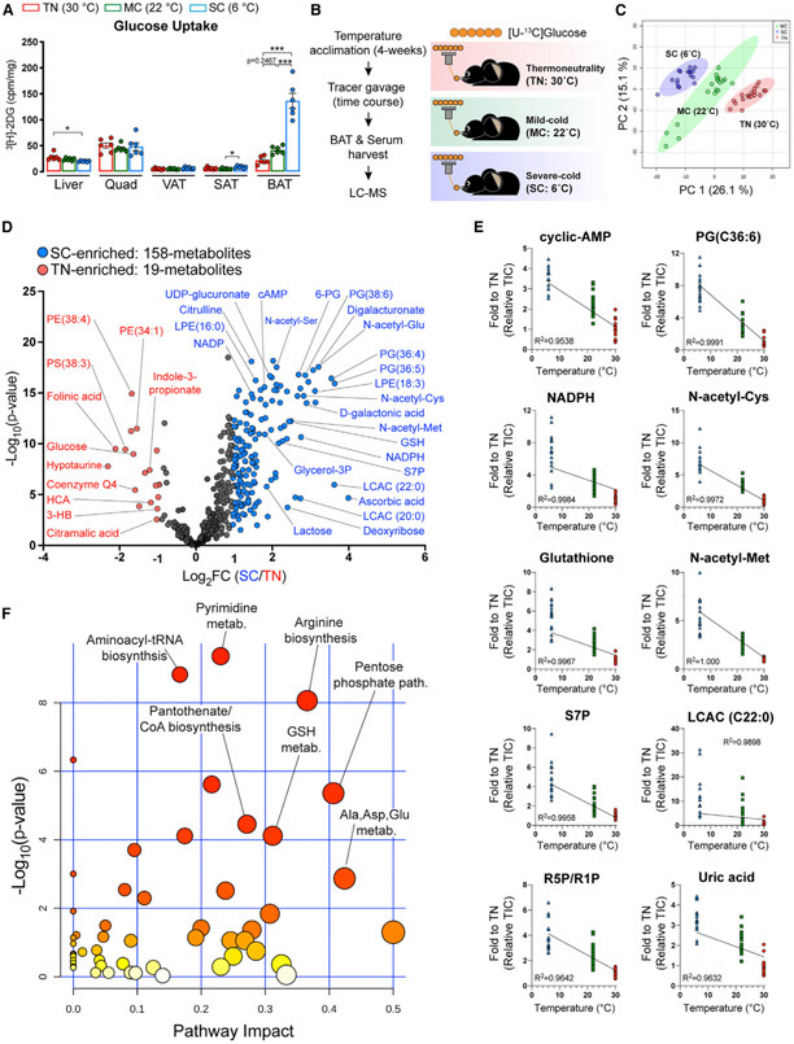
图2.寒冷(SC)环境影响了棕色脂肪组织(BAT)的代谢组变化
(A)在适应性环境中(TN,红色,30°C;MC,绿色,22°C;SC,蓝色,6°C)4周,小鼠口服3H-2DG,分别收集皮下脂肪组织(SAT)、内脏脂肪组织(VAT)、腹股沟白色脂肪组织(WAT)和围腺白色脂肪组织(WAT)。(B)在适应性环境中(TN,红色,30°C;MC,绿色,22°C;SC,蓝色,6°C)4周,小鼠口服[U-13C]葡萄糖示踪剂,通过液相色谱-质谱(LC-MS)测量血清和BAT中的代谢物水平。(C)对适应TN、MC和SC的小鼠BAT代谢组进行主成分分析(PCA)。(D)火山图显示TN与SC组别小鼠BAT代谢组的差异代谢物。(E)显示与温度变化呈线性关系变化的代谢物。(F)对比TN与SC组别小鼠揭示BAT代谢组通路发生变化。
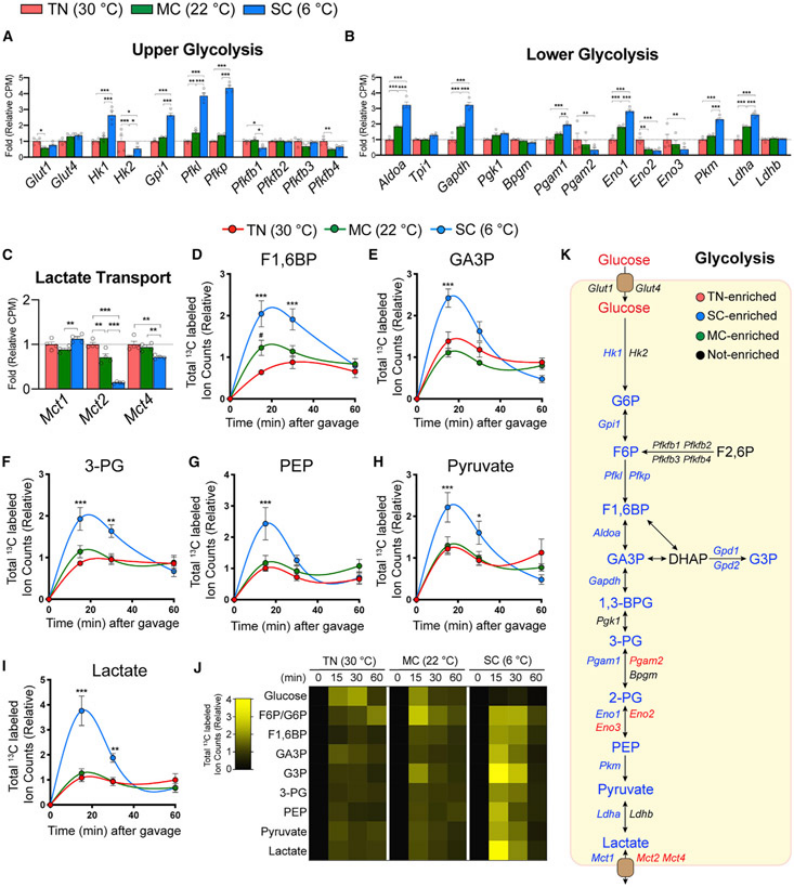
图3.结合转录组数据和代谢流分析,揭示低温条件下棕色脂肪组织糖酵解通量增加
(A-C)在适应性环境中(TN,红色,30°C;MC,绿色,22°C;SC,蓝色,6°C)4周,RNA测序分析不同组别小鼠基因表达的不同,包含糖酵解通路上部分相关基因(A),糖酵解通路下部分相关基因(B),以及乳酸转运蛋白相对基因(C)的表达变化。(D-I)显示BAT中指定糖酵解中间体的总标记碳原子数量随时间的变化。(J)热图显示指定糖酵解代谢物中相对总标记碳原子的数量。(K)卡通图显示糖酵解途径,不同颜色表示某个温度条件下小鼠转录丰度显著更高。
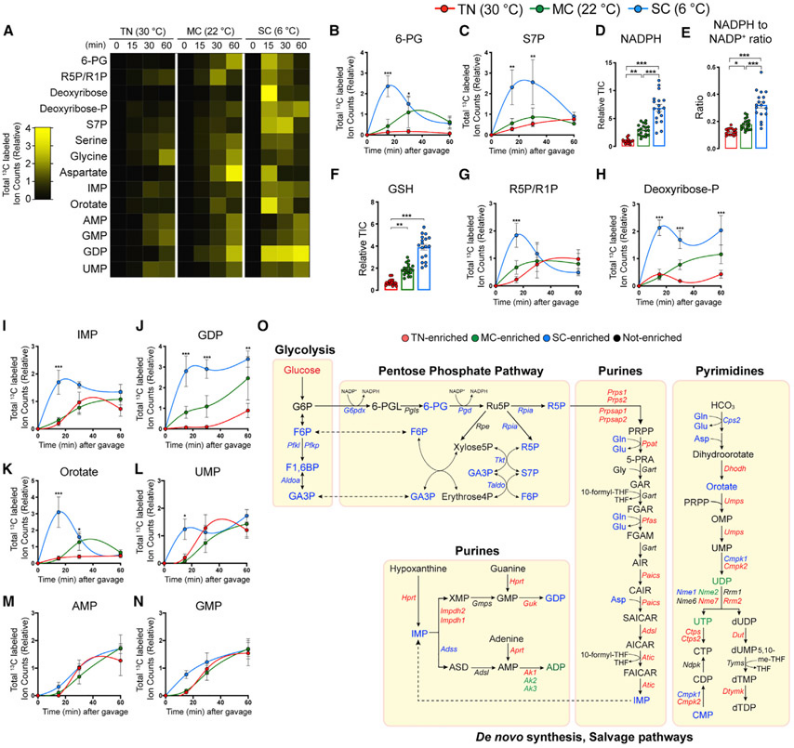
图4.显示低温环境下棕色脂肪组织(BAT)中葡萄糖流入戊糖磷酸途径,有助于抗氧化和核苷酸合成
(A)在适应性环境中(TN,红色,30°C;MC,绿色,22°C;SC,蓝色,6°C)4周,小鼠代谢组分析热图显示不同组别之间,戊糖磷酸途径、核苷酸以及核苷酸生物合成中的关键氨基酸中的相对总标记碳原子的变化。(B和C)显示BAT中戊糖磷酸途径中间体的总标记碳原子。(D)BAT中总NADPH的相对丰度。(E)BAT中NADPH与NADP+的相对丰度。(F)BAT中总谷胱甘肽(GSH)的相对丰度。(G和H)BAT中核糖磷酸物种的总标记碳原子。(I–N)BAT中嘌呤/嘧啶生物合成中间体的总标记碳原子。(O)卡通图显示糖酵解的分支途径,包括戊糖磷酸途径、核苷酸、糖原和己糖胺生物合成以及核苷酸糖途径。
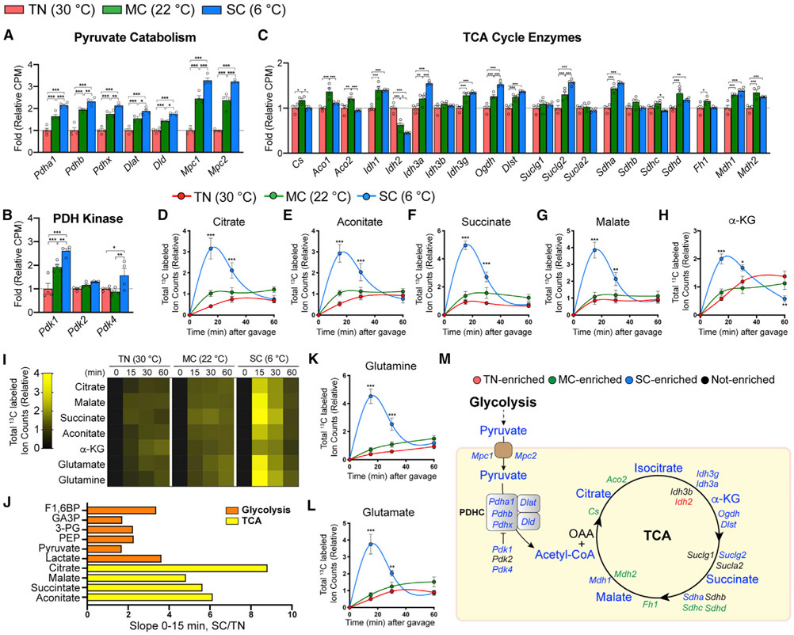
图5.显示寒冷环境增加了葡萄糖流入TCA循环的通量
(A-C)在适应性环境中(TN,红色,30°C;MC,绿色,22°C;SC,蓝色,6°C)4周,小鼠RNA测序分析显示不同组别之间,小鼠棕色脂肪组织(BAT)中丙酮酸代谢和转运蛋白、丙酮酸脱氢酶(PDH)激酶和TCA循环酶的相对基因水平比较。(D-H)显示不同组别小鼠BAT中几种TCA中间体的总标记碳原子的变化。(I)显示了不同组别小鼠BAT中几种TCA中间体的相对总标记碳原子在不同时间点的比较。(J)条形图显示了SC与TN组别小鼠相比,几种代谢物在0-15分钟内的相对变化。(K和L)显示不同组别小鼠BAT中谷氨酰胺(K)和谷氨酸(L)的总标记碳原子的相对比较。(M)卡通图显示TCA循环,不同颜色表示某个温度组同位素标记或转录本丰度更高。
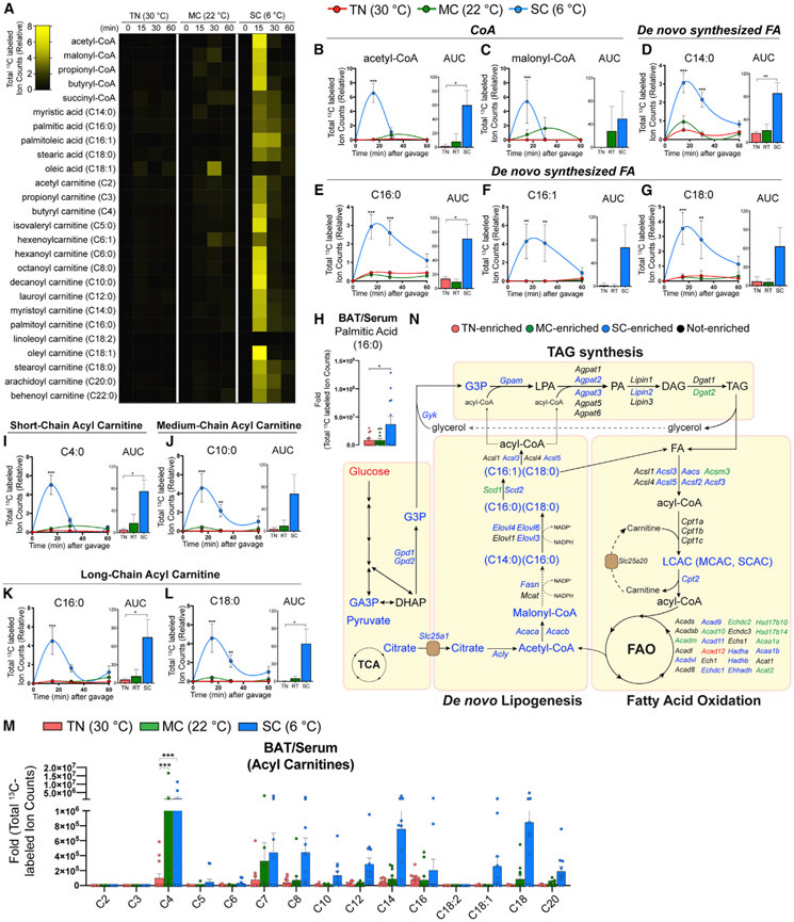
图6.显示寒冷环境加速了棕色脂肪组织(BAT)对葡萄糖用于脂肪酸合成和氧化的利用
(A)在适应性环境中(TN,红色,30°C;MC,绿色,22°C;SC,蓝色,6°C)4周,小鼠代谢流分析显示不同组别之间,BAT中脂肪酸及前体和酰基肉碱的相对总标记碳原子变化。(B和C)不同组别小鼠BAT中CoA物种的总标记碳原子及60分钟曲线下面积(AUC)的不同。(D-G)不同组别小鼠BAT中脂肪酸的总标记碳原子及60分钟AUC的不同。(H)不同组别小鼠BAT中棕榈酸的相对总标记碳原子与血清的比较。(I-L)不同组别小鼠BAT中酰基肉碱的总标记碳原子及60分钟AUC的对比。(M)不同组别小鼠BAT中酰基肉碱物种的相对总标记碳原子与血清的比较。(N)卡通图显示脂肪酸合成、三酰甘油(TAG)合成和脂肪酸氧化的途径图,不同颜色表示某个温度组的同位素标记或转录丰度显著更高。
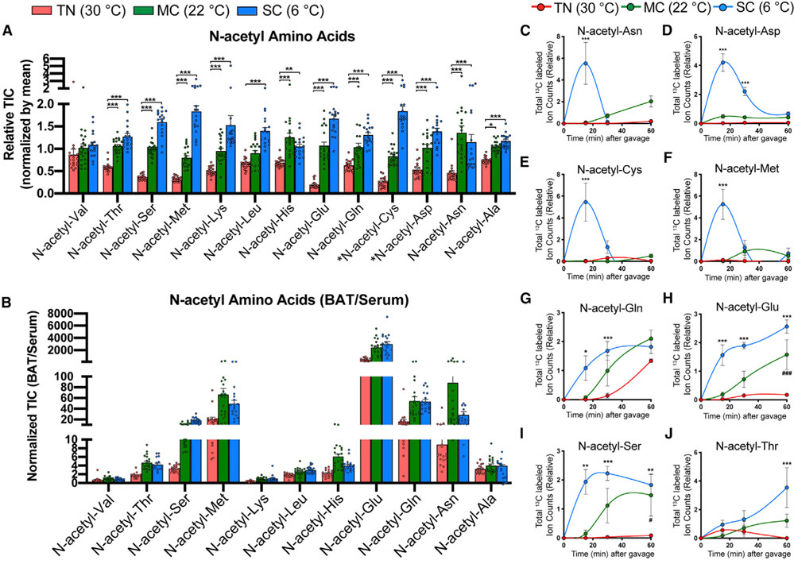
图7.显示寒冷环境下棕色脂肪组织(BAT)中N-乙酰氨基酸高度富集
(A)在适应性环境中(TN,红色,30°C;MC,绿色,22°C;SC,蓝色,6°C)4周,小鼠代谢流分析显示不同组别之间,N-乙酰氨基酸的相对丰度的变化。(B)不同组别之间BAT与血清间N-乙酰氨基酸相对丰度的不同。(C-J)不同组别之间BAT中几种N-乙酰氨基酸的总标记碳原子的差异。
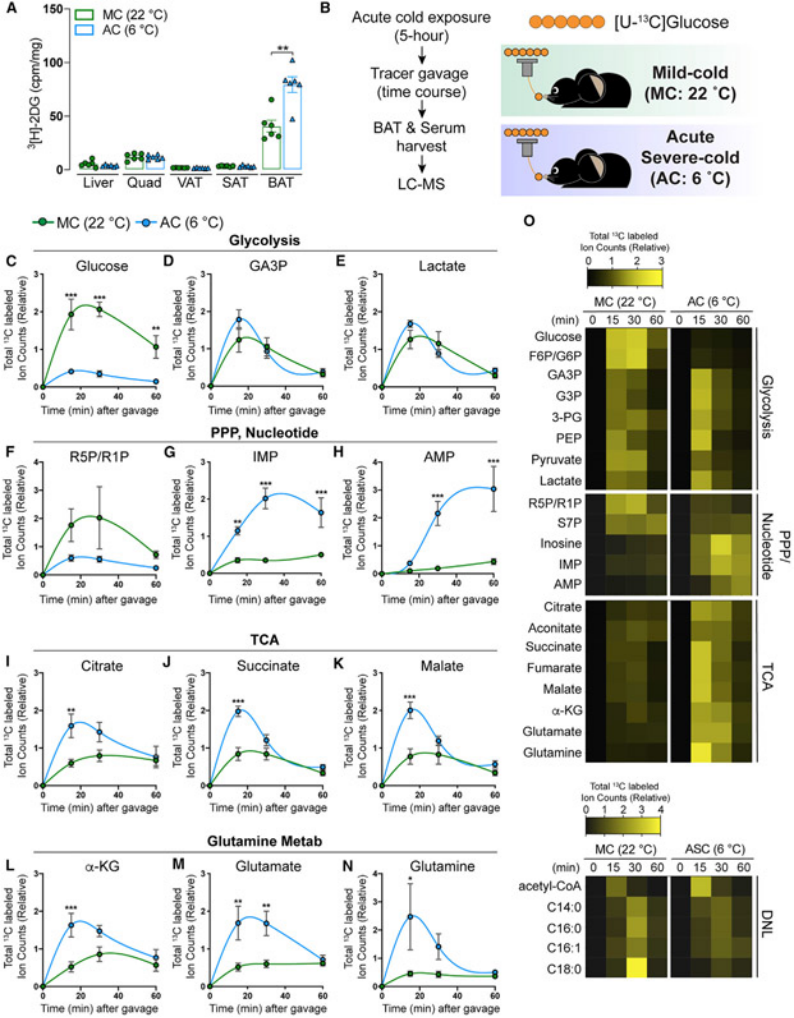
图8.显示急性寒冷增加了葡萄糖流入糖酵解、TCA循环和戊糖磷酸途径,但没有增加脂肪酸的从头合成
(A)急性寒冷环境(AC,蓝色,6°C,5小时)或适应性室温环境(MC,绿色,22°C)的小鼠中,口服给予3H-2DG后收集皮下脂肪组织(SAT)、内脏脂肪组织(VAT)、腹股沟白色脂肪组织(WAT)和围腺白色脂肪组织(WAT)。(B)急性寒冷环境(AC,蓝色,6°C,5小时)或适应性室温环境(MC,绿色,22°C)的小鼠开展代谢流实验。(C-E)急性寒冷环境(AC,蓝色,6°C,5小时)或适应性室温环境(MC,绿色,22°C)的小鼠开展代谢流检测显示糖酵解几种中间体的总标记碳原子不同。(F-H)急性寒冷环境(AC,蓝色,6°C,5小时)或适应性室温环境(MC,绿色,22°C)的小鼠开展代谢流检测显示戊糖磷酸途径和核苷酸生物合成几种中间体的总标记碳原子不同。(I-K)急性寒冷环境(AC,蓝色,6°C,5小时)或适应性室温环境(MC,绿色,22°C)的小鼠开展代谢流检测显示TCA中间体的总标记碳原子不同。(L-N)急性寒冷环境(AC,蓝色,6°C,5小时)或适应性室温环境(MC,绿色,22°C)的小鼠开展代谢流检测显示α-酮戊二酸(L)、谷氨酸(M)和谷氨酰胺(N)中的总标记碳原子不同。(O)急性寒冷环境(AC,蓝色,6°C,5小时)或适应性室温环境(MC,绿色,22°C)的小鼠开展代谢流检测,热图显示几种指定代谢物相对总标记碳原子差异及变化。
05总结与启发
该篇文献发表于Cell Reports(IF>10),文献采用了转录组学、代谢组学和稳定同位素追踪的综合方法,通过比较不同温度条件下的代谢变化,研究了环境因素对代谢的影响。
研究通过代谢流技术,揭示了葡萄糖在棕色脂肪组织中的多种代谢途径,包括糖酵解、TCA循环、戊糖磷酸途径和脂肪酸合成,展示了代谢途径之间的交叉和相互作用,如葡萄糖如何通过不同的代谢途径被转化为能量和其他生物分子,研究结果表明,代谢流的调控涉及多个层面,包括转录调控和转录后调控机制。
简而言之,文献提供了关于棕色脂肪组织代谢的深入理解,也为开发治疗肥胖、糖尿病和其他代谢性疾病的新疗法提供潜在靶点。
参考文献
Jung,S.M.,Doxsey,W.G.,Le,J.,Haley,J.A.,Mazuecos,L.,Luciano,A.K.,Li,H.,Jang,C.,&Guertin,D.A.(2021).In vivo isotope tracing reveals the versatility of glucose as a brown adipose tissue substrate.Cell Reports,36(7),109836.https://doi.org/10.1016/j.celrep.2021.07.026
华测多组学科研服务AI+靶向代谢组学智能临床转化平台亮相第二届多组学科研大会
2024年3月30日至31日,第二届多组学科研与临床应用大会在上海丽昂豪生大酒店盛大开幕,大会以“聚焦多组学,从科研到临床”为主题,吸引了国内外众多专家学者相关的基础研究、临床应用、产业从业者参与,全场座无虚席。
2024-04-02 00:59:15
柿子变身记:这个冬天,“柿柿”如意
CTI华测检测可为您提供柿子等新鲜果蔬的营养品质、农药残留、产地环境等检测套餐服务。我们拥有专业的技术支持团队与一流的检测团队,为食品安全保驾护航。
2021-12-22 09:02:36
CTI华测检测开通深圳地区数字证书业务
随着2021深圳全球招商大会举行,当前深圳进入了“双区”驱动、“双区”叠加的黄金发展期,国际一流营商环境催生了377万户商事主体。近日,华测CA顺应市场所需助力网上商事登记,在深圳已推出个人数字证书业务,ODC组织机构数字证书业务也即将上线。
2021-12-20 06:06:12
- 热线电话
- 业务咨询
- 快速询价
- 在线客服
- 报告验证





